Метилирование при раке было описано фразой «слишком много, но слишком мало». При раке одни участки ДНК гиперметилированы, а другие гипометилированы, что приводит к полному нарушению нормального цикла метилирования ДНК. (8)
Метилирование: молекулярные механизмы преждевременного старения
Многие инновации и достижения в индустрии красоты были разработаны благодаря изучению биохимических процессов на молекулярном уровне. Молекулярный уровень — это изначальная базовая структура человеческого тела.
Изучение генетической и эпигенетической регуляции биохимических реакций обладает огромным потенциалом для новых открытий в области антивозрастной терапии.
В настоящее время метилирование молекул представляет большой интерес. Подробнее об этом процессе и связи между метилированием и преждевременным старением читайте в этой статье на estet-portal.com.
Метилирование — биохимический процесс, происходящий в клетках непрерывно
Метилирование, также известное как одноуглеродный обмен, — это биохимический процесс, который постоянно происходит в каждой клетке нашего организма. Как следует из названия, он включает в себя добавление метильных групп в состав молекул. Несбалансированное метилирование является краеугольным камнем преждевременного старения и многочисленных возрастных дегенеративных заболеваний.
Несбалансированное метилирование является краеугольным камнем преждевременного старения и многочисленных возрастных дегенеративных заболеваний.
Процесс метилирования молекул тесно связан с другими биохимическими реакциями в организме, такими как:
1. синтез ДНК и РНК, биосинтез пуриновых нуклеотидов,
2. экспрессия генов и сайленсинг генов,
3. метаболизм нейротрансмиттеров,
4. метаболизм эстрогенов,
5. регуляция иммунной системы,
6. биотрансформация и антиоксидантная активность,
Подробнее о роли метилирования в синтезе ДНК, РНК и пуриновых нуклеотидов и о том, существует ли связь между метилированием и преждевременным старением, читайте далее в статье.
Метилирование: синтез ДНК и РНК, биосинтез пуриновых нуклеотидов
Многочисленные научные исследования показали, что синтез ДНК и РНК, а также биосинтез пуриновых нуклеотидов нарушаются при хроническом дефиците доноров метилфосфата, в частности фолата (витамина B9), что способствует дефектам экспрессии генов, началу апоптоза и канцерогенеза.
Исследование с использованием чувствительной модельной системы in vitro (аденома простаты трансгенной мыши, имитирующая рак простаты) продемонстрировало роль фолата в запуске генетических, эпигенетических и фенотипических изменений в организме.
Читайте нас в Telegram
Метилирование ДНК является хорошо известным эпигенетическим механизмом
Метилирование ДНК — один из известных эпигенетических механизмов, регулирующих экспрессию и фенотип генов человека. В здоровых клетках процесс метилирования обеспечивает правильную регуляцию экспрессии генов (без изменения последовательности ДНК), а также их «глушение».
Метилирование ДНК происходит в так называемых CpG-областях (областях ДНК, где цитозин расположен рядом с гуанином). Регионы, где CpG-сайты расположены вблизи промоторов генов, теперь называются CpG-островами.
Недавние исследования показали, что метилирование ДНК в регионах CpG-островов, деацетилирование гистонов и метилирование гистонов приводят к замораживанию генов. Нарушения в экспрессии генов, вызванные гиперметилированием промотора эпигенетических CpG-островков, могут привести к канцерогенезу (так называемое «неадекватное сайленсирование»).
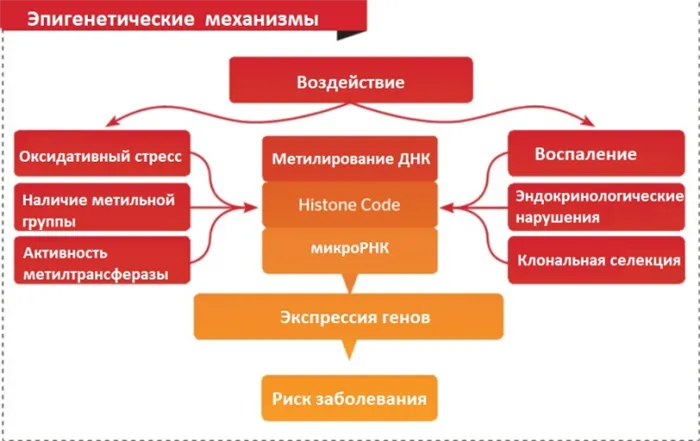
Метилирования играет ключевую роль в удалении экзогенных токсинов
Метилирование играет ключевую роль в выведении экзогенных токсинов из организма человека. В ходе этого процесса метильные группы связываются с токсинами и способствуют связыванию и выведению ксенобиотиков и канцерогенов, включая тяжелые металлы, такие как ртуть, свинец и мышьяк.
Читайте нас в Telegram
Метилирование также способствует выработке глутатиона, таурина и цистеина. Эти вещества участвуют в воспалительных и регенеративных реакциях, а также являются мощными антиоксидантами. Глутатион, в частности, способствует нейтрализации свободных радикалов и реактивных форм кислорода, а также активации экзогенных антиоксидантов (витаминов С и Е) в их восстановленной форме.
Дефицит метилирования может быть причиной преждевременного старения
Многочисленные научные исследования показали, что дефицит или дисбаланс метилирования может быть причиной преждевременного старения и, в частности, способствовать появлению седых волос в молодом возрасте.
Существует связь между гипометилированием и развитием сердечно-сосудистых заболеваний, атеросклероза, диабета, слабоумия, болезни Альцгеймера, болезни Паркинсона, дисбаланса нейротрансмиттеров и других психических расстройств.
Было показано, что патологические изменения в местах метилирования ДНК связаны не только с биологическим старением, но и с продолжительностью жизни.
Эпигенетический дрейф, который приводит к дисбалансу в метилировании ДНК, является фундаментальным аспектом процесса старения.
Что такое метилирование и почему оно важно для нашего здоровья?
Человеческое тело состоит из триллионов клеток. Их слаженная работа позволяет нам оставаться здоровыми. Одним из важнейших процессов, без которого жизнь клеток и всего организма была бы невозможна, является метилирование.
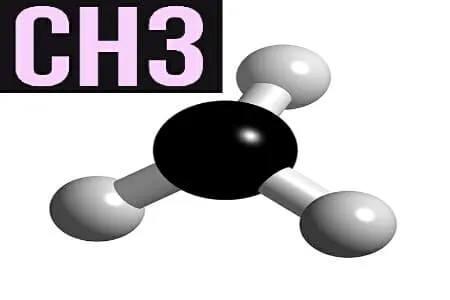
Метилирование — это биохимическая реакция, в ходе которой метильная группа, состоящая из одного углерода и трех молекул водорода, превращает аминокислоту метионин в S-аденозилметионин (SAM-e).
Полученный SAM-e может перемещаться по организму и передавать метильные группы другим соединениям, таким как ДНК и нейротрансмиттеры.
В результате высвобождения метильных групп SAM-e превращается в гомоцистеин — аминокислоту, из которой в крови образуется мощный антиоксидант глутатион. Процесс метилирования цикличен и непрерывен, как и дыхание.
Почему это так важно для здоровья?
Метилирование — это саморегулируемый процесс, но он может быть нарушен тем или иным образом. Например, гомоцистеин, образующийся под действием SAM-e, обычно должен быть преобразован обратно в метионин, чтобы начать цикл заново.
Если в организме недостаточно витамина B12 или фолата, или если имеется дефект в одном из ферментов, ответственных за переработку гомоцистеина, происходит образование гомоцистеина.
Последствия избытка гомоцистеина:
- повышение свертывания крови;
- сердечно-сосудистые заболевания;
- астма;
- болезнь Паркинсона;
- аутизм;
- деменция;
- синдром дефицита внимания и гиперактивности (СДВГ).
Избыток гомоцистеина сопровождается недостатком антиоксидантов, что приводит к окислительному стрессу. Окислительный стресс снижает активность метилирования, и патологический цикл замыкается.
Что такое ген MTHFR?
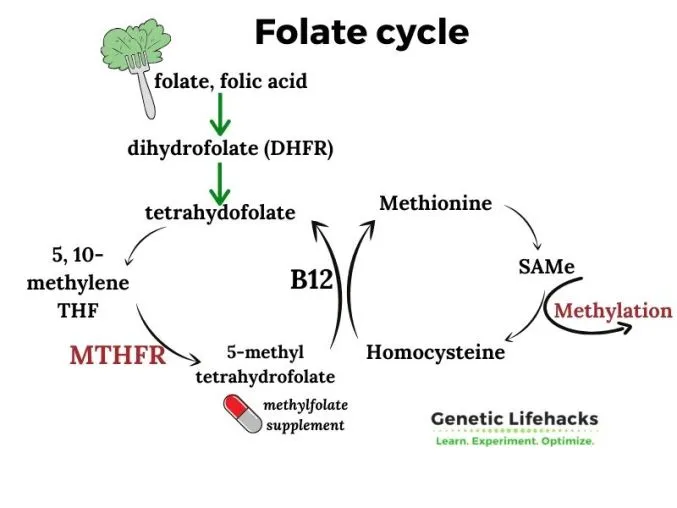
Ген MTHFR кодирует фермент, известный как метилтетрагидрофолат редуктаза или MTHFR. Этот фермент отвечает за превращение 5,10-метил-THF в 5-метил-THF, который необходим для преобразования гомоцистеина в метионин.
Этот фермент очень важен для производства ДНК и путей метилирования, которые необходимы для всех функций организма.
MTHFR также играет центральную роль в преобразовании фолиевой кислоты в SAM (аденозилметионин), универсальный донор метила в клетках, и влияет на состояние метилирования ДНК.
Типы метилирования ДНК
Метилирование — это основа эпигенетики, науки о том, как окружающая среда влияет на наши гены. Окружающая среда, образ жизни и диета — это факторы, которые могут включать или выключать гены. Показанные здесь закономерности метилирования и деметилирования могут влиять на здоровье, старение и хронические заболевания, такие как риск развития рака.
Хотя избыточное или недостаточное метилирование может быть вредным, важно понять, какие именно гены включаются или выключаются. Активация или деактивация определенных ключевых генов или регионов может привести к серьезным осложнениям для здоровья (например, гипометилирование так называемых повторяющихся последовательностей при раке).
Гиперметилирование ДНК
Здоровый организм имеет определенный уровень метилирования. Неправильное и чрезмерное метилирование ДНК может изменить активность гена и помешать ему выполнять то, на что он запрограммирован. Изменения в положении метильных групп могут вызывать заболевания.
Некоторые ученые использовали количество метилирования в определенных генах в качестве биологических часов, поскольку количество метилирования в отдельных генах пропорционально возрасту. Эти эффекты могут привести к таким заболеваниям, но не ограничиваются ими:
- Онкологические заболевания.
- Снижение функции иммунной системы.
- Ухудшение здоровья мозга.
- Снижение энергии и возможностей физической активности.
- Ускорение старения.
Чрезмерное метилирование ДНК может инактивировать и снижать экспрессию определенных генов-супрессоров опухолей, способствуя развитию рака.
Кроме того, внешние факторы окружающей среды могут изменять метилирование. Другими словами, аномальное метилирование в ДНК может передаваться по наследству, но этот баланс также может быть изменен всем, что нас окружает.
Гипометилирование ДНК
Слишком низкий уровень метилирования также может быть вреден. Когда ДНК недостаточно метилирована, в организме может возникнуть геномная нестабильность и клеточные изменения.
Хотя считалось, что гиперметилирование чаще встречается при раке, последние исследования показали, что гипометилирование также играет определенную роль в развитии рака. Гипометилирование может оказывать положительное влияние на рак в краткосрочной перспективе, но оно также может ускорять рост опухоли.
Метилирование при раке было описано фразой «слишком много, но слишком мало». При раке одни участки ДНК гиперметилированы, а другие гипометилированы, что приводит к полному нарушению нормального цикла метилирования ДНК.
Помимо рака, гипометилирование может также способствовать развитию воспаления, приводящего к атеросклерозу и аутоиммунным заболеваниям, таким как волчанка и рассеянный склероз.
Деметилирование ДНК
Деметилирование ДНК также может играть определенную роль в развитии злокачественных опухолей.
Во время эмбрионального развития этот процесс имеет решающее значение. Ученые давно пытаются понять, как сложные биохимические сигналы передаются эмбриону, чтобы идентичные стволовые клетки могли вырасти в специализированные клетки, ткани и органы. Деметилирование происходит в ранних эмбрионах и необходимо для того, чтобы стволовые клетки дифференцировались в определенные типы клеток. Было показано, что участки ДНК активируются или деактивируются для здорового развития организма и впоследствии изменяются путем деметилирования.
Метилирование и старение: эпигенетические часы
Метилирование не является черно-белым явлением. И дело не только в том, больше или меньше метилирована ваша ДНК, но и в том, как именно. Было установлено, что метилирование усиливается в детстве, когда происходит большая часть этого процесса. Однако с возрастом только определенные участки ДНК — регионы CpG — становятся чрезмерно метилированными, в то время как остальная часть ДНК остается недостаточно метилированной. Это состояние считается признаком старения.
Используя картину метилирования CpG, ученые теперь могут предсказать возраст человека. Это называется «эпигенетические часы», биомаркер старения, основанный на специфическом прогрессивном метилировании, характерном для большинства людей, который сообщает нам наш «функциональный возраст». Но существует также «аберрация», присущая каждому человеку, — паттерн, несколько отличающийся от общей популяции, называемый «эпигенетическим дрейфом», который ученые изучают чаще всего.
По сути, ученые могли бы определить ваш «эпигенетический возраст» на основе картины метилирования ДНК и сравнить его с вашим реальным возрастом. Исходя из этого, вы можете быть эпигенетически моложе или старше. И если вы эпигенетически старше, это может указывать на большую вероятность развития проблем со здоровьем в ближайшем будущем.
Метилирование – секрет биохимии здоровья
Метилирование является предметом всеобщего внимания в индустрии здоровья, и не зря. Это биохимический процесс, участвующий почти во всех функциях нашего организма!
Метилирование — это присоединение атома углерода и трех атомов водорода (так называемая метильная группа — CH3) к другой молекуле. Удаление метильной группы называется деметилированием. Подумайте о миллиардах маленьких переключателей в вашем теле, которые буквально управляют всем: Ваша реакция на стресс, выработка организмом энергии из пищи, химия мозга и даже очищение организма. Все эти процессы в организме происходят посредством химических реакций, таких как метилирование и деметилирование.
Контроль метиловой группы:
1) реакция организма на стресс, 2) производство и переработка глутатиона, главного антиоксиданта организма, 3) детоксикация гормонов, химических веществ и тяжелых металлов, 4) воспаление, 5) экспрессия генов и восстановление ДНК, 6) медиаторы и химические процессы в мозге, 7) восстановление поврежденных клеток свободными радикалами, 8) иммунный ответ, контроль производства Т-клеток, борьба с инфекциями и вирусами, регулирование иммунного ответа.
Если у вас недостаток метильных групп или нарушен цикл метилирования, любой из вышеперечисленных процессов в организме может быть нарушен, и вы можете заболеть. Исследования показали, что нарушенное метилирование четко связано с аутоиммунными заболеваниями.
Метилирование и глутатион
Улучшение метилирования очень важно для всех нас, но особенно для людей, страдающих аутоиммунными заболеваниями. Одна из причин этого — роль метилирования в производстве и переработке глутатиона, важнейшего антиоксиданта организма. Глутатион непосредственно нейтрализует свободные радикалы, уменьшает воспаление и усиливает роль других антиоксидантов (витаминов С, Е и липоевой кислоты).
Глутатион содержит серные группы, которые являются клейкими соединениями, позволяющими ему связывать и выводить из организма токсины и тяжелые металлы. К сожалению, у многих людей (особенно с аутоиммунными заболеваниями!) недостаточное метилирование и низкий уровень глутатиона.
Наш организм может синтезировать собственный глутатион из аминокислот (цистеина, глицина и глутамина), а затем перерабатывать его путем метилирования с помощью доноров метильных групп (витамин B12, фолиевая кислота, бетаин и другие питательные вещества). В нормальных условиях организм вырабатывает и перерабатывает достаточное количество глутатиона, чтобы нейтрализовать любые токсины, которым вы подвергаетесь. Однако если в организме высокая токсическая нагрузка или нарушена любая часть цикла метилирования, человек может сильно заболеть.
Как улучшить метилирование?
Ниже приведены естественные методы улучшения процесса метилирования.
- Употребляйте в пищу целебную зелень. Ежедневно ешьте темные листовые зеленые овощи, которые являются природными источниками фолиевой кислоты (донора метильных групп), которая необходима для правильного метилирования. Убедитесь в том, что ежедневно употребляете не менее двух чашек этих целебных продуктов.
- Принимайте витамины группы В и фолиевую кислоту. Донорами метильной группы являются: фолиевая кислота, витамин В6, В12 и рибофлавин. Источниками этих витаминов являются рыба, яйца, темная зелень, спаржа, миндаль, семена подсолнечника и грецкие орехи.
- Убедитесь, что вы получаете достаточное количество магния и цинка, которые поддерживают метилирование.
- Принимайте пробиотики. Помните, что хорошие бактерии помогают получать и усваивать из пищи витамины группы В и фолиевой кислоты.
- Снизьте уровень стресса, не употребляйте алкоголь, бросьте курить, следите за тем, чтобы в организм попадало меньше токсических веществ. Эти токсины нагружают печень и используют метильные группы.
Варианты гена MTHFR
Генетические вариации в гене MTHFR приводят к снижению активности фермента MTHFR и связаны с различными заболеваниями и состояниями организма, включая сердечно-сосудистые заболевания, неврологические аномалии, некоторые виды рака, психические расстройства, диабет и осложнения беременности. (3, 4)
p, blockquote 27,0,0,0,0 —>
Двумя наиболее распространенными мутациями (полиморфизмами) гена MTHFR у людей являются rs1801133 и rs1801131.
p, blockquote 28,0,0,0,0 —>
rs1801133 (MTHFR C677T)
Аллель А этого полиморфизма связан со снижением активности фермента MTHFR, повышением уровня общего гомоцистеина и изменением распределения фолиевой кислоты. (1) У людей с аллелем А нормальная активность MTHFR снижена на 35%, тогда как у людей с генотипом АА она снижена на 70%. (5)
p, blockquote 29,0,0,0,0 —>
Характеристика r s1801133:
- Каждый аллель А был связан с более низкой активностью метилирования и более высоким уровнем гомоцистеина (2)
- Генотип AA показывает снижение активности фермента MTHFR на 70%
- Генотип AG демонстрирует 30-40% сниженной активности фермента (68, 69, 70)
rs1801131 (MTHFR A1298C)
Эта мутация также влияет на активность фермента MTHFR и уровень гомоцистеина, но в меньшей степени, чем rs1801133 (1).
p, blockquote 30,0,0,0,0 —>
Активность фермента MTHFR у людей с минорным аллелем мутации rs1801133 ниже, чем у людей с минорным аллелем мутации rs1801131 ( 6).
p, blockquote 31,0,0,0,0 —>
Снижение активности фермента MTHFR приводит к снижению преобразования аминокислоты гомоцистеина в метионин и накоплению гомоцистеина в крови. Аномально повышенный уровень гомоцистеина называется «гомоцистеинурией» или «гипергомоцистеинемией». (4)
p, blockquote 32,0,0,0,0 —>
Повышенный уровень гомоцистеина в крови может увеличить восприимчивость к различным заболеваниям. (3, 4)
p, blockquote 33,0,0,0,0 —>
Многочисленные исследования связывали полиморфизмы MTHFR, в частности rs1801133, с различными заболеваниями, но результаты иногда были противоречивыми. Это несоответствие может объясняться небольшими размерами выборки и этническими факторами, которые влияют на характер заболеваний в различных популяциях по всему миру. (2)
p, blockquote 34,0,0,0,0 —>
Заболевания, связанные с мутациями гена MTHFR
Связь между определенным генотипом и физическим состоянием или заболеванием не обязательно означает, что генотип вызывает заболевание. Однако аллель А полиморфизма rs1801133 был связан с многочисленными заболеваниями, включая детские болезни:
- Инсульты различного рода в различных популяциях людей (7, 8, 9, 10) и инсульты у детей (11)
- Заболевания сердца при снижении уровня фолиевой кислоты (12)
- Высокое кровяное давление (также при генотипе GG MTHFR rs1801131 ) (13)
- Мужское бесплодие, особенно в азиатских популяциях (14, 15, 16, 17)
- Депрессия (высокий уровень гомоцистеина и дисфункция метаболических путей метилирования имеют решающее значение для синтеза норадреналина и серотонина) (18, 19)
- Расстройства аутистического спектра (20, 21, 22, 23)
- Болезнь Альцгеймера (24, 25)
- Деменция (26)
- Болезнь Паркинсона (24, 25)
- Рассеянный склероз (хотя доказательства противоречивы) (27, 28, 29)
- Ревматоидный артрит (30)
- Синдром дефицита внимания и гиперактивности (СДВГ) (при rs1801131 ) (31)
- Мигрени с аурой или без нее (32, 33, 34). Другое исследование показало, что генотип АА был обратно связан с мигренями. Однако у людей с генотипом АА, у которых были мигрени, значительно чаще возникали проблемы с сердцем. (35)
- Сахарный диабет и диабетические проблемы почек (нефропатия) у пациентов с сахарным диабетом 2-го типа. Риски варьируются между европейскими, азиатскими, арабскими и китайскими (ханьскими) популяциями. (36, 37, 38, 39)
- Шизофрения (40, 41)
- Униполярное депрессивное расстройство и биполярное расстройство (40, 41)
- Нарушение слуха (49)
- Снижение плотности костной ткани в позвоночнике и его шейном отделе (50)
- Кластерная головная боль (51)
- Эпилепсия (52)
- Заболевания периферических артерий (53)
- Худшие исходы при терминальной стадии заболевания почек (54)
- Побочные эффекты приема метотрексата при ревматоидном артрите (55) и повышенная токсичность для печени от метотрексата (блокатора фолатов) (56)
- Рецидивирующая потеря беременности (выкидыши) (57, 58)
- Преэклампсия – серьезное осложнение беременности (59)
- Синдром Дауна у ребенка (если у матери есть один или оба аллеля А) (60)
- Дефекты нейронной трубки, такие как анэнцефалия и расщепление позвоночника у новорожденных (61)
- Расщелина губы и неба (62)
- Низкий уровень лютеинизирующего гормона (63)
- Катаракта (64)
- Очаговая алопеция (65)
- Более тяжелое течение колита (66)
- Рак: ранее было доказано, что дефицит фолиевой кислоты может увеличить частоту различных форм рака. MTHFR непосредственно участвует в метаболизме фолатов, и поэтому мутации MTHFR могут оказывать влияние на развитие рака. (2, 42)
- Повышенный риск развития – рак предстательной железы (2, 42)
- Рак яичников (2, 42)
- Рак пищевода (2, 42)
- Рак желудка (2, 42): люди с аллелем А были более склонны к развитию рака желудка после инфекции H.Pylori (43)
- Рак мочевого пузыря (2, 42)
- Рак головного мозга (44)
- Рак легких (45)
- Рак почки (46)
- Рак головы и шеи (47)
- Рак толстой кишки и другие побочные эффекты от лечения 5-фторурацилом (48)
Дополнительные возможности по влиянию на метилирование ДНК
Анализы на уровень гомоцистеина и фолиевой кислоты
Следует отметить, что большинство исследований генов MTHFR показывают связь с заболеванием только при высоком уровне гомоцистеина или низком уровне фолатов. Поэтому вы можете спросить своего врача, нужно ли вам проверить уровень фолиевой кислоты или гомоцистеина. Высокий уровень гомоцистеина указывает на то, что у вас может быть проблема с метилированием или дефицит витамина B12/фолиевой кислоты, который также вызван возможной мутацией в гене MTHFR.
p, blockquote 37,0,0,0,0 —>
Если ваши анализы покажут высокий уровень гомоцистеина, врач, вероятно, порекомендует вам соответствующую диету и прием витаминов. Этот план, вероятно, будет включать повышенное потребление фолиевой кислоты, витамина B12 и витамина B6, которые влияют на уровень гомоцистеина в крови. (4)
p, blockquote 38,0,0,0,0 —>
Диета, богатая этими витаминами, включая фрукты, овощи, темную листовую зелень (шпинат, капусту, бок-чой и мангольд), яйца и красное мясо, обеспечивает необходимое количество витаминов группы В для поддержания низкого уровня гомоцистеина. Кроме того, добавление всех трех веществ может еще больше повысить уровень гомоцистеина. (4)
p, blockquote 39,0,0,0,0 —>
У здоровых контрольных лиц уровень гомоцистеина составлял менее 7 мкмоль/л, в то время как у больных шизофренией в среднем 12 мкмоль/л. (67)
p, blockquote 40,0,0,0,0 —>
Биодоступность фолиевой кислоты
Недавно было обнаружено, что кишечник человека может очень эффективно преобразовывать фолат из пищи в 5-MTHF (тип фолата, который наш организм может использовать). Однако его способность преобразовывать дополнительную искусственную фолиевую кислоту ограничена. (71)
p, blockquote 41,0,0,0,0 —>
Рекомбинантная фолиевая кислота ((6S)5-MTHF) — это биодоступная форма фолиевой кислоты, которая легко усваивается и метаболизируется человеческим организмом. Он доступен в виде пищевых добавок, обычно под названием L-метилтетрагидрофолат или метилфолат (72, 73, 74).
p, blockquote 42,0,0,0,0 —>
Вы также можете принимать метилвитамин B12 (метилкобаламин), более биодоступную форму витамина B12, вместо обычного витамина B12. Это облегчает усвоение витамина B12 вашим организмом.
p, blockquote 43,0,0,0,0 —>
Если у вас генотипы AA rs1801133 и GG rs180113 1 в гене MTHFR, для вашего здоровья будет лучше поговорить с врачом о добавках и других способах улучшения состояния.
p, blockquote 44,0,0,0,0 —>
Потребность в фолиевой кислоте
В настоящее время рекомендуемое потребление фолиевой кислоты составляет 400 мкг/день для среднего взрослого человека и увеличивается до 600 мкг/день для беременных и кормящих женщин. (4)
p, blockquote 45,0,0,0,0 —>
Помните, что добавки фолиевой кислоты, как известно, корректируют существующую анемию, вызванную недостаточным уровнем витамина B12. Чтобы избежать дефицита B12, сообщите своему врачу о любых добавках или лекарствах, которые вы планируете принимать.(75)
Обогащенная среда в детском и раннем подростковом возрасте
Мы видим, насколько важны условия окружающей среды в раннем возрасте для развития поведения. Часто определяются различные чувствительные периоды, в которые внешняя среда оказывает значительное влияние на развитие организма. Обычно это третий триместр беременности и ранний послеродовой период, к которым недавно добавились начало беременности и особенно препубертатный и ранний подростковый периоды. В течение этого периода благоприятные условия могут исправить вредные последствия предыдущего воздействия: обогащенная среда, в которой содержатся экспериментальные животные, более просторные клетки, больше животных в одной клетке, игрушки разных форм и цветов, больше возможностей для физической активности. Они увеличивают сенсорные, когнитивные, моторные и визуальные стимулы и социальное поведение 23. У животных, выращенных в такой среде, с одной стороны, улучшается обучение и память, исправляются аномалии развития, но с другой стороны, впоследствии развиваются симптомы различных генетических заболеваний ЦНС, таких как болезнь Хантингтона, болезнь Альцгеймера, болезнь Паркинсона, эпилепсия и др.
После двух недель пребывания в обогащенной среде экспериментальные животные с генетическим дефектом памяти достигли показателей памяти примерно здоровых мышей 23. Тот же эффект вызывал ингибитор деацетилазы, который увеличивает ацетилирование гистонов на определенных участках ДНК и активирует их транскрипцию. Такое состояние ДНК и гистонов часто связано с их пониженным метилированием, о чем сообщалось ранее. Улучшение памяти в обогащенной среде наблюдалось не только у подопытных животных, но и у их потомства первого поколения.
Появление эпигенетических меток в геноме зависит как от внешних условий, так и от генотипа. Это могут быть мутации, которые заменяют цитозин на другой нуклеотид в динуклеотидах CpG или изменяют уровень метионина. Однако существует небольшое количество экспериментов, показывающих, что эпигенетические сигналы могут наследоваться, не завися от генотипа или материнской среды 1-3. Быстрое развитие генетики и обилие новых данных продолжают раскрывать новые аспекты эпигенетических механизмов, регулирующих активность генома.
Литература 1. Jaenisch R., Bird A. Epigenetic regulation of gene expression: how the genome integrates intrinsic and environmental signals // Nat. Genet. 2003. v. 33. p. 245-254. 2. Skinner M. K., Anway M. D., Savenkova M. I. et al. Transgenerational epigenetic programming of the brain transcriptome and anxiety behavior // PLoS One. 2008. v. 3. e3745. 3. dias B. G., Ressler K. J. Родительский обонятельный опыт влияет на поведение и нейронную структуру в последующих поколениях // Nat. Neurosci. 2014. v. 17. p. 89-96. 4. Morgan H. D., Santos F., Green K. et al. эпигенетическое перепрограммирование у млекопитающих // Hum. Mol. Genet. 2005. v. 14. r. 47-58. Feng J., Chang H., Li E., Fan G. Dynamic expression of de novo DNA methyltransferases Dnmt3a and Dnmt3b in the central nervous system // J. Neurosci. Res. 2005. v. 79. p. 734-746. 6, Cervoni N., Champagne F. A. et al. Epigenetische Programmierung durch mütterliches Verhalten // Nat. Neurosci. 2004. S. 847-854. 7. McGowan P. O., Sasaki A., D’Alessio A. C. et al. Epigenetische Regulierung des Glucocorticoidrezeptors im menschlichen Gehirn steht in Zusammenhang mit Missbrauch in der Kindheit // Nat. Neurosci. 2009. v. 12. p. 342-348. 8. Meaney M. J., Diorio J., Francis D. et al. Early environmental regulation of forebrain glucocorticoid receptor gene expression: implications for adrenocortical responses to stress // Dev. Neurosci. 1996. v. 18. p. 49-72. Herbeck Y. E., Gulevich R. G., Amelkina O. A. et al. Conserved methylation of the glucocorticoid receptor gene exon 1-7 promoter in rats subjected to a maternal methyl-supplemented diet // Int. J. Dev. Neurosci. 2010. V. 28. S. 9-12. 10. Macri S., Mason G. J., Wurbel H. Differential effects of neonatal maternal separation on maternal care and offspring HPA and fear responses in rats // Eur. J. Neurosci. 2004. V. 20. S. 1017-1024. 11. McGowan P. O., Suderman M., Sasaki A. et al. Broad epigenetic signature of motheral care in the brain of adult rats // PLoS One. 2011. v. 6. e14739. 12. Tremblay R. E., Szyf M. Developmental origins of chronic physical aggression and epigenetics // Epigenomics. 2010. V. 2. S. 495-499. 13. Provençal N., Suderman M. J. et al. Association of childhood chronic physical aggression with a DNA methylation signature in adult human T cells // PLoS One. 2014. V. 9. e89839. 14. Vallée M., Mayo W., Dellu F. et al. Pränataler Stress induziert hohe Ängstlichkeit und postnatale Manipulation induziert niedrige Ängstlichkeit bei erwachsenen Nachkommen: Korrelation mit stressinduzierter Kortikosteronsekretion // J. Neurosci. 1997. v. 17. p. 2626-2636. 15. Khashan A. S., Abel K. M., McNamee R. et al. Erhöhtes Risiko für Schizophrenie bei Nachkommen, wenn die Mutter vor der Geburt schweren negativen Lebensereignissen ausgesetzt war // Arch. Gen. 2008. V. 65. S. 146-152. 16. Jensen Peña C., Monk C., Champagne F. A. Эпигенетические эффекты пренатального стресса на 11β-гидроксистероиддегидрогеназу-2 в плаценте и мозге плода // PLoS One. 2012. V. 7. e39791. 17. Rodrigues A. J., Leão P., Pêgo J. M. et al. Mechanismen der Auslösung und Umkehrung von drogensuchendem Verhalten, das durch pränatale Exposition gegenüber Glukokortikoiden ausgelöst wird // Mol. Psychiatry. 2011. V. 17. S. 1295-1305. 18. Ван ден Вейвер И. Б. Генетические эффекты метилирующих диет // Annu Rev Nutr. 2002. V. 22. S. 255-282. 19. Blusztajn J. K. Choline, a vital amine // Science. 1998. V. 281. S. 794-795. 20. Е., Оськина И. Н., Гулевич Р. Г., Плюснина И. З.
Избыточное метилирование ДНК
Биохимия избыточного метилирования ДНК
Влияние материнской метил-богатой диеты на экспрессию генов глюкокортикоидных рецепторов в гиппокампе ведущих себя крыс // Цитол. Генет. 2010. Т. 44. № 2. С. 108-113. 21. Albert F. W., Shchepina O., Winter C. et al. Phenotypic differences in behavior, physiology and neurochemistry between rats selected for tameness and defensive aggression towards humans // Horm. Behav. 2008. v. 53. p. 413-421. 22. Jadavji N. M., Deng L., Leclerc D. et al. Severe methylenetetrahydrofolate reductase deficiency in mice leads in behavioral abnormalities with morphological and biochemical changes in hippocampus // Mol. Генет. Metab. 2012. v. 106. p. 149-159. 23. Arai J. A., Feig L. A. Долгосрочные и межпоколенческие эффекты обогащения окружающей среды на формирование памяти // Brain Res. Bull. 2011. v. 85. № 1-2. p. 30-35.
Симптомы избыточного метилирования ДНК
Гиперметилирование противоположно неметилированию. Если у вас гиперметилирование, у вас, вероятно, высокий уровень серотонина, низкий уровень гистамина и, вероятно, мало абсолютных базофилов. Вы также можете обнаружить высокий уровень меди и низкий уровень цинка в вашем анализе.
- СДВГ. Сверхметиляторы часто имеют симптом дефицита внимания с гиперактивностью.
- Беспокойство. В некоторых случаях чрезмерное метилирование может привести к увеличению уровня тревоги и склонности к паническим атакам.
- Творческие наклонности. Некоторые исследователи предполагают, что существует связь творческих наклонностей с чрезмерным метилированием. Данная теория еще подлежит изучению.
- Склонность к депрессиям. Люди с избыточным метилированием могут впадать в депрессию из-за высокого уровня серотонина, отсутствия мотивации и успеха.
- Сухость кожи. Также было высказано предположение, что чрезмерно метилированные люди, как правило, более предрасположены к сухой коже.
- Чувствительность к пище. Если Вы сверхметилированы то, можете заметить, что вы очень чувствительны к определенным продуктам питания и/или химическим веществам.
- Разочарование. Другим признаком среди сверхметиляторов является частое чувство разочарования или состояние расстройства, которое возникает без, казалось бы, веских причин.
- Высокий порог боли. Считается, что избыточное метилирование может быть причиной более высокой толерантности к боли.
- Низкое либидо. Еще одним симптомом чрезмерного метилирования является снижение либидо. Такие люди могут быть значительно меньше заинтересованы в сексе (если говорить о взрослых).
- Низкая мотивация. Общая тенденция избыточного метилирования ДНК является низкая производительность на рабочем месте или в конкурентной среде. Это часто является прямым следствием отсутствия мотивации, что может быть побочным продуктом чрезмерного метилирования.
- Нервозность. Генерализованне беспокойство, которое человек может почувствовать в результате чрезмерного метилирования.
- Навязчивые идеи. Некоторые исследователи предполагают, что люди с избыточным метилированием могут иметь явные навязчивые идеи.
- Паранойя. Среди тех, кто сильно страдает от такого отклонения метилирования, могут возникать параноидальные мысли и, возможно, слуховые галлюцинации.
- Самостоятельная изоляция. Те, кто изолируются от других, могут делать это частично из-за депрессии и/или тревоги, связанной с сверхметилированием.
- Самоагрессия. Исследователи утверждают, что избыточное метилирование ДНК имеет место быть среди лиц, причиняющих себе вред и увечья.
- Нарушения сна. Люди с проблемами сна чаще страдают от сверхметилирования.
Коррекция избыточного метилирование ДНК
Лечение чрезмерного метилирования ДНК
Вот список симптомов, которые могут возникнуть при избыточном метилировании. Обратите внимание, что избыточное метилирование ДНК не обязательно вызывает каждый симптом из списка и что тяжесть каждого симптома зависит от конкретного человека.
Добавки и коррекция избыточного метилирования ДНК
При наличии избыточного метилирования многие эксперты рекомендуют протокол лечения продолжительностью 3-6 месяцев. Обычно улучшения наступают не сразу, а постепенно, в течение нескольких месяцев. Для лечения избыточного метилирования рекомендуется обратиться к специалисту в этой области для разработки конкретной программы лечения. Коррекция рациона и прием пищевых добавок могут помочь нормализовать состояние здоровья или уменьшить симптомы, связанные с нарушениями метилирования ДНК.
Не занимайтесь самолечением, коррекция метилирования ДНК должна проводиться под наблюдением квалифицированного специалиста.
Побочные эффекты от препаратов
Для нормализации процесса в сочетании со специальной диетой показаны такие добавки, как DMAE, фолиевая кислота (фолат), ниацинамид, омега-3 жирные кислоты, витамин B6 (P5P), витамин C, витамин E и цинк.
- Антигистамины. Поскольку уровень гистамина уже низкий, вы плохо будете реагировать на любые антигистаминные препараты. У лиц с избыточным уровнем метилирования, как правило, меньше аллергических реакций, чем обычно из-за низкого содержания гистамина.
- Бензодиазепины. У пациентов с избыточным метилированием наблюдались положительные реакции при приеме бензодиазепинов.
- Литий. Стабилизирующий настроение агент литий также заметно улучшает состояние тех, кто чрезмерно метилирован.
- Эстрогенная терапия. Если при избыточном метилировании ДНК осуществляется терапия эстрогенами то, вероятно, будет наблюдаться негативная реакция.
- SAM-e. Эту добавку следует избегать всем, кто испытывает чрезмерное метилирование. Скорее всего некоторые симптомы могут усиливаться, поскольку SAM-e еще больше увеличит метилирование
- SSRI или 5-HTP. В общем, у сверхметилированных лиц уже имеется высокий уровень серотонина и не требуются SSRI или 5-HTP. Дальнейшее увеличение уровня серотонина может вызвать серьезные побочные реакции.
Лечение заболеваний с помощью коррекции метилирования ДНК
Если у вас есть мутация MTHFR, которая приводит к избыточному метилированию, вам следует остерегаться возможных реакций на некоторые лекарства.
- экологических
- вирусных
- бактериальных
- синдром высокой проницательности кишечника
- дисбаланс микробиоты кишечника
- другие факторы
Нормализация метилирования ДНК, т.е. исправление мутации MTHFR, с помощью специальной диеты и добавок может уменьшить или устранить симптомы заболевания и значительно улучшить здоровье, в том числе психическое. Однако это не означает, что вы можете полностью избавиться от определенных симптомов и полностью вылечить определенное заболевание. Вы также должны знать, что проблемы со здоровьем могут быть результатом комбинации факторов, таких как
- www.ncbi.nlm.nih.gov/books/NBK6561/
- www.instagram.com/holistic_autism/








