Печень обладает повышенной скоростью синтеза и распада белка по сравнению с другими тканями организма (за исключением поджелудочной железы). Таким образом, он может синтезировать «на экспорт» и быстро обеспечивать хрупкий запас аминокислот во время недоедания, расщепляя собственные белки.
8.2.2. Биосинтез мочевины и его нарушения
Глутамин поступает в печень, где фермент глутаминаза высвобождает аммиак, который преобразуется в мочевину. Аминокислота орнитин участвует в синтезе мочевины, поэтому синтез мочевины называется орнитиновым циклом.
Основным местом синтеза мочевины является печень.
Ключевыми ферментами в биосинтезе мочевины являются карбамоилфосфат синтаза, ортонинкарбамоилтрансфераза и аргиназа. Источниками азота для мочевины являются аммиак и аспаргиновая кислота. Орнитиновый цикл тесно связан с циклом Кребса. Фумаровая кислота из орнитинового цикла «убегает» в цикл Кребса. Цикл трикарбоновых кислот, в свою очередь, снабжает цикл орнитина молекулами АТФ.

Особенности выведения конечных азотистых продуктов у детей
Больше аминокислотного азота и креатинина
У детей могут быть обнаружены нарушения в синтезе мочевины, что приводит к повышению концентрации аммиака в крови и тканях. Они проявляются в виде рвоты, судорог после приема белковосодержащих продуктов. Симптомы отравления облегчаются белковой диетой. Нарушения образования мочевины связаны с отсутствием или низкой активностью ферментов, участвующих в этом процессе.
Ферменты, участвующие в цикле мочевины
Ферменты, участвующие в «связывании» аммония с мочевиной, следующие:
— Карбамоилфосфат синтаза I, которая участвует в синтезе карбамоилфосфата из бикарбоната и ионов аммония.
— Орнитин трансхарбамилаза, которая катализирует перенос карбамоильной группы от карбамоилфосфата к орнитину с образованием цитруллина.
— Аргиносукцинат синтетаза, которая катализирует конденсацию цитруллина с молекулой аспартата с образованием аргиносукцината.
— Аргининосукциновая лиаза или аргининосукциназа необходима для «расщепления» аргининосукцината на аргинин и фумарат.
— Аргиназа, которая может превращать аргинин в мочевину и орнитин.
Этапы цикла мочевины
Цикл мочевины, открытый Гансом Кребсом и Куртом Хенсельхайтом в 1932 году, происходит в клетках печени, поскольку печень является органом, в который «направляются» все ионы аммония, образующиеся в различных тканях организма.
После того как из аммиака образуется мочевина, она транспортируется по кровотоку в почки, где выводится с мочой в качестве отработанного продукта.
Цикл состоит из пяти ферментативных этапов, два из которых происходят в митохондриях клеток печени, а три — в цитозоле.
Первый этап: этап грунтования
Для запуска цикла мочевины ионы аммония должны сначала попасть в печень и в митохондриальный матрикс гепатоцитов.
Ионы аммония могут поступать из молекул-носителей, таких как глутамат, они могут поступать в результате окисления аминокислот в кишечнике (при посредничестве кишечных бактерий) или в результате мышечного распада определенных белков в организме.
Однако независимо от их источника ионы аммония, образующиеся в митохондриях гепатоцитов, быстро превращаются в карбамоилфосфат в АТФ-зависимой реакции путем соединения с ионами бикарбоната (HCO3-), образующимися во время митохондриального дыхания.
Эта реакция (реакция инициации или активации) катализируется ферментом карбамоилфосфат синтетазой I и требует потребления 2 молекул АТФ, а именно:
Ионы аммония (NH4+) + ионы бикарбоната (HCO3-) + 2ATP → карбамоилфосфат + 2ADP + Pi.
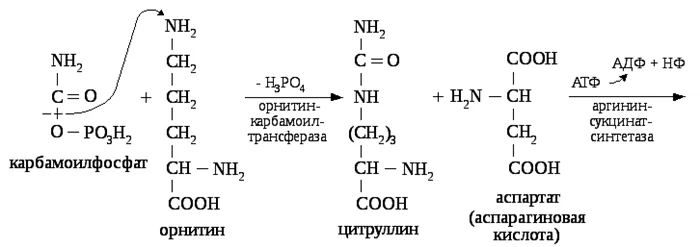
Образование цитруллина – первая реакция орнитинового цикла.
Цитруллин, как и орнитин, является важной аминокислотой, которая не кодируется генетически.
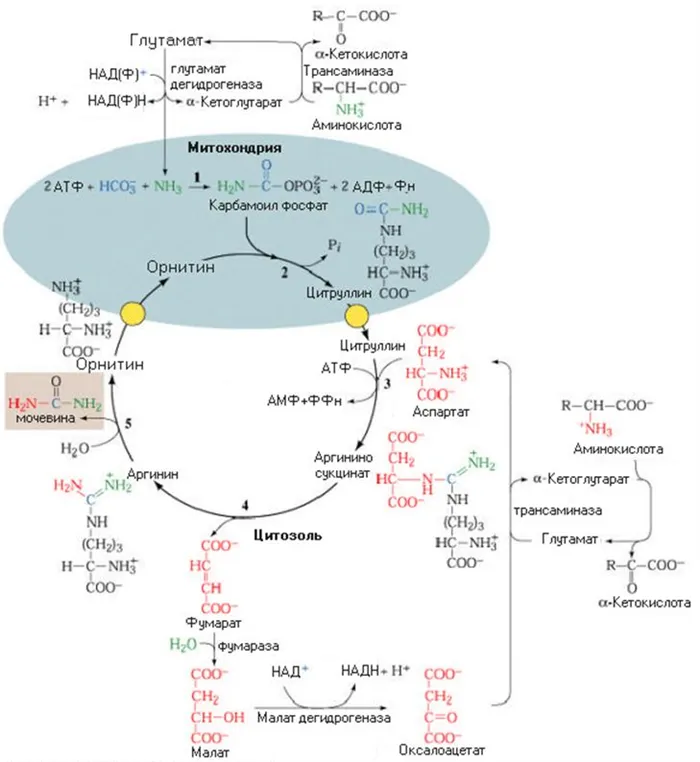
Орнитиновый цикл синтеза мочевины
Образование цитруллина происходит с использованием богатого энергией карбамоилфосфата и катализируется орнитинкарбамоилтрансферазой (OCT). Продукт реакции, цитруллин, транспортируется в цитозоль, где завершается образование мочевины.
Для синтеза аргининосукцината необходима АТФ
Аминогруппа аспаргиновой кислоты является источником второго атома азота в молекуле мочевины. Конденсация аспаргиновой кислоты с цитруллином катализируется синтазой аргининосукциновой кислоты (AS) и сопровождается гидролизом АТФ до АМФ и пирофосфата (NPP). Поскольку пирофосфатазы быстро гидролизуют пирофосфат до двух фосфатных остатков, реакция сдвигается в сторону синтеза аргининосукциновой кислоты.
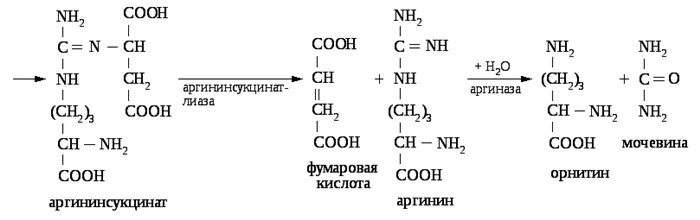
Аргинин синтезируется путем расщепления аргининосукциновой кислоты
Реакция деградации аргининосукциновой кислоты катализируется аргининосукциновой лиазой (AL), а образующийся аргинин является прямым предшественником мочевины. Фумаровая кислота, продукт этой реакции, связывает этот процесс с другими метаболическими путями, такими как цикл Кребса, глюконеогенез и синтез заменимых аминокислот.
Распад аргинина обеспечивает образование мочевины и восстанавливает орнитин.
Гидролиз гуанидиновой группы аргинина катализируется ферментом аргиназой, который в небольших количествах содержится и в других органах (почки, мозг и т.д.), но наиболее активен в печени. Мочевина поступает в кровь путем диффузии по градиенту концентрации и транспортируется в почки, где фильтруется и выводится из организма. Около 25 % его попадает в кишечник, где становится субстратом для уреазы. Другой продукт реакции, рнитин, транспортируется обратно в митохондрии и участвует в следующем раунде цикла синтеза мочевины.
Общая реакция синтеза мочевины
Аспартовая кислота + NH3+ CO2+ 3ATP
3 H2O + мочевина + фумарат + 2ADP + AMP + 2PH + пирофосфат
Цикл мочевины и цикл трикарбоновых кислот тесно связаны на субстратном уровне (см. рисунок).
Один атом азота обеспечивается ионом аммония, а другой — аспаргиновой кислотой. Глутаминовая кислота является прямым предшественником как аммиака, так и аспаргиновой кислоты.
Синтез мочевины является регулируемым процессом
Быстрая регуляция синтеза мочевины происходит на уровне КФС-1. Этот фермент аллостерически регулируется N-ацетилглутаминовой кислотой. Последний синтезируется в митохондриях из глутамата и ацетил-КоА. Реакция катализируется синтазой, которая, в свою очередь, активируется аргинином.
Ацетил-КоА + глутамат N-ацетилглутаминовая кислота + КоА
Вовлечение цикла орнитина и лимонной кислоты на субстратном уровне.
Уровень N-ацетилглутаминовой кислоты зависит от соотношения активности синтазы N-ацетилглутаминовой кислоты и гидролазы N-ацетилглутаминовой кислоты, катализирующей гидролиз этого соединения.
Долгосрочная регуляция направлена на синтез новых ферментов. Индукция синтеза определяется содержанием белка в рационе. Повышенное потребление пищевого белка увеличивает синтез всех ферментов, участвующих в синтезе мочевины. Это показано в следующей таблице:
Особенности обмена глицина
Когда серин превращается в глицин, образуется N5,N10-метилен-ТГФК:
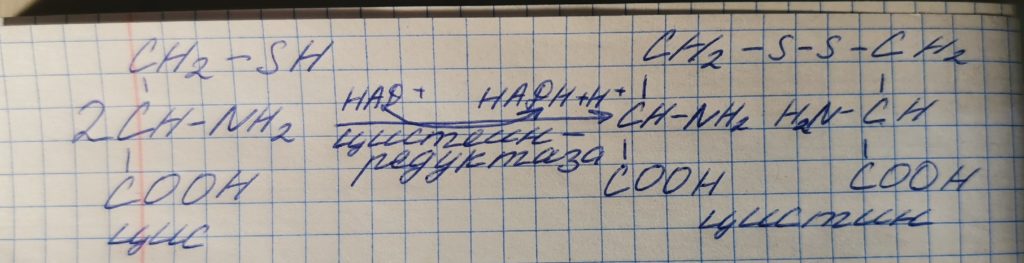
Глицин может быть образован из:
- порфирины – гемоглобин
- серин ——>фосфолипиды
- парные желчные кислоты
- пуриновые основания и нуклеиновые кислоты
- креатин и креатинфосфат
- гиппуровая кислота
- глутатион
- глиоксиловая кислота HOOC-C(=O)-H —>-С(=О)-Н + CO2 – формиат связывается с ТГФК и используется для синтеза ДНК, РНК и т.д.
Органы с высоким метаболизмом аминокислот и биогенных аминов — нервная ткань, печень, кишечник, мышцы — являются наиболее активными производителями в крови.
Основные источники:
- неокислительное дезаминирование некоторых аминокислот (серина, треонина, гистидина) – в печени.
- окислительное дезаминирование глютаминовой кислоты во всех тканях, кроме мышечной.
- катаболизм биогенных аминов – во всех тканях, в наибольшей степени – в нервной ткани.
- дезаминирование амидов глютаминовой и аспарагиновой кислот – в печени и почках.
- жизнедеятельность бактерий толстого кишечника.
- распад пуриновых и пиримидиновых оснований во всех тканях.



Характеристика основных путей обезвреживания аммиака. Временное обезвреживание аммиака, виды, химизм, ферменты, значение
Аммиак токсичен, особенно для нервной системы.
Норма для аммиака составляет 11-32 мкмоль/литр. Когда он повышен, это стимулирует нервную систему. Критический уровень составляет 60 мкмоль/литр — угнетение ЦНС и кома.
Небольшое количество аммиака может идти на синтез заменителей аминокислот, азотистых оснований и т.д. Большая часть аммиака удаляется.
Временная дезактивация аммиака — амиды аспаргиновой и глутаминовой кислот образуются во всех тканях, наиболее активно в нейронах.
Пути дезактивации аммиака:
1) Образование амидов (аспаргиновой и глутаминовой кислот).

Затем глютамин и аспарагин транспортируются по кровотоку в печень и почки, где происходит окончательная детоксикация.
2) Синтез солей аммония.
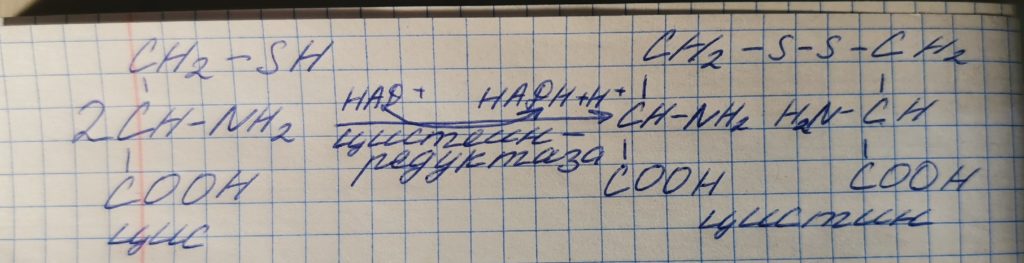
3) восстановительное аминирование альфа-кетоглутаровой кислоты.
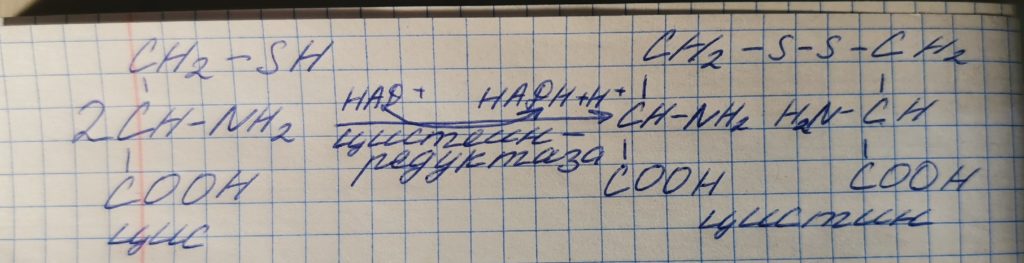
4) Синтез мочевины, основной путь детоксикации аммиака (подробнее см. пункт 10).
Значение: Аммиак токсичен и поэтому должен быть преобразован в «безвредное» соединение или выведен из организма. Мочевина, которая синтезируется из аммиака, гораздо менее токсична, чем аммиак.
Прием белка
Нормальное (но не оптимальное) суточное потребление белка для среднего человека составляет около 100 граммов. Кроме того, около 70 граммов белка выводится через желудочно-кишечный тракт. Из этого количества поглощается около 160 граммов. Организм синтезирует в среднем 240-250 г белка в день. Такая разница между всасыванием и эндогенной трансформацией свидетельствует об активности процессов восстановления исходного сложного химического соединения из «фрагментов», образовавшихся в ходе его метаболизма (ресинтез белков из аминокислот и аминокислот из аммиака и «углеродных скелетов» аминокислот).
Для здорового человека характерен азотистый баланс, когда потеря белка (через мочу, кал, кожу и т.д.) равна количеству, поступившему с пищей. При преобладании катаболических процессов возникает отрицательный азотистый баланс, что характерно для низкого поступления азотистых веществ (низкобелковая диета, голодание, нарушения усвоения белка) и для многочисленных патологических процессов, вызывающих повышенный распад (опухоли, ожоги и т.д.). Когда преобладают синтетические процессы, количество поступающего азота превалирует над выведением, и возникает положительный азотистый баланс, характерный для детей, беременных женщин и людей, проходящих лечение от серьезных заболеваний.
После прохождения кишечного барьера белки попадают в кровь в виде свободных аминокислот. Следует отметить, что клетки слизистой желудочно-кишечного тракта могут метаболизировать некоторые аминокислоты (включая глутаминовую кислоту и аспаргиновую кислоту до аланина). Способность энтероцитов модифицировать эти аминокислоты может предотвратить токсические эффекты при их избыточном введении.
Аминокислоты, как те, которые поступают в кровь в процессе переваривания белка, так и те, которые синтезируются в клетках, образуют постоянно обновляющийся свободный резервуар аминокислот в крови, составляющий около 100 г.
Путь белка
75 % аминокислот, находящихся в кровообращении организма, составляют аминокислоты с разветвленной цепью (лейцин, изолейцин и валин). Аланин, важнейший предшественник синтеза глюкозы, и глутамин выводятся из мышечной ткани в кровь. Многие свободные аминокислоты метаболизируются в печени. Часть свободного пула включается в белки организма и после распада вновь попадает в кровь. Другие подвергаются катаболическим реакциям напрямую. Некоторые свободные аминокислоты используются для синтеза новых азотистых соединений (пурин, креатинин, адреналин) и далее деградируют, не возвращаясь в свободный пул, до специфических продуктов деградации.
Печень обеспечивает стабильность содержания различных аминокислот в крови. Он потребляет около ⅓ всех аминокислот, поступающих в организм, тем самым предотвращая скачки их концентрации в зависимости от рациона питания.
Основная роль печени в метаболизме азота и других веществ обусловлена ее анатомическим расположением — продукты пищеварения поступают в этот орган непосредственно через воротную вену. Кроме того, печень напрямую связана с выделительной системой — желчными протоками, что позволяет выводить определенные соединения через желчь. Гепатоциты — единственные клетки, которые имеют полный набор ферментов, участвующих в метаболизме аминокислот. Здесь происходят все основные процессы азотного обмена: расщепление аминокислот для производства энергии и глюконеогенеза, образование заменителей аминокислот и нуклеиновых кислот, нейтрализация аммиака и других конечных продуктов. Печень является основным местом распада большинства незаменимых аминокислот (за исключением аминокислот с разветвленной цепью).
Инсулиновый ответ
Синтез азотистых соединений (белков и нуклеиновых кислот) в печени очень чувствителен к поступлению их предшественников из рациона. После каждого приема пищи наступает период повышенного внутрипеченочного синтеза белков, включая альбумин. Аналогичное увеличение синтетических процессов наблюдается и в мышцах. Эти реакции в основном обусловлены действием инсулина, который выделяется в ответ на введение аминокислот и/или глюкозы.
Некоторые аминокислоты (аргинин и аминокислоты с разветвленной цепью) увеличивают выработку инсулина больше, чем другие. Другие (аспарагин, глицин, серин, цистеин) стимулируют секрецию глюкагона, который увеличивает утилизацию аминокислот печенью и действует на ферменты глюконеогенеза и распада аминокислот. Эти механизмы снижают уровень аминокислот в крови после приема пищи. Эффект инсулина наиболее выражен для аминокислот, которые присутствуют в кровотоке в свободной форме (аминокислоты с разветвленной цепью), тогда как для аминокислот, которые транспортируются в связанной форме (триптофан), он не имеет большого значения. Глюкокортикостероиды оказывают противоположное действие на белковый обмен, что и инсулин.
Что такое мочевина?
Мочевина — это органическое соединение, которое образуется в организме человека как конечный продукт распада. Он выводится в основном через почки, а также через пот. Мочевина содержит вещество «аммиак», которое является токсичным для человека. Он накапливается в организме через различные пути метаболизма аминокислот, затем преобразуется в мочевину и выводится из организма.
Цикл мочевины — это цепь метаболических реакций в организме человека. Он упаковывает токсичное вещество аммиак в форму мочевины и безопасно высвобождает его. В организме человека органические вещества постоянно образуются, расщепляются или превращаются друг в друга. Аминокислоты играют важную роль в этом процессе.
Аминокислоты являются компонентом белков. Поэтому они являются самым важным строительным материалом для организма. Другими словами, аминокислоты образуются при расщеплении белков. При расщеплении аминокислот образуется множество различных веществ.
Некоторые из них имеют углеродный скелет и поэтому могут обеспечивать организм энергией. Однако другим основным компонентом продуктов распада является азот. Он преобразуется в:
- аммиак – NH3;
- аммиак – NH4 + в сочетании с водородом.
Чтобы аммиак не накапливался в организме, его необходимо постоянно удалять. Поскольку вещество выводится через почки и является токсичным, его необходимо сначала хорошо упаковать.
Это происходит во время цикла мочевины. Цикл мочевины происходит частично в митохондриях и частично в плазматических клетках печени и потребляет много энергии.
Образующаяся мочевина транспортируется через кровь в почки, фильтруется и добавляется в мочу. В этом процессе мочевина выполняет свою вторую функцию — она помогает почкам вырабатывать мочу, создавая градиент концентрации. Поэтому он не только постоянно выводится только через почки, но и играет важнейшую роль в работе почек.
В каких случаях врач назначает анализ?
Мочевина используется для диагностики различных заболеваний почек и обмена веществ. Определение мочевины часто используется для оценки функции почек. Для диагностики этот тест часто назначается вместе с тестом на креатинин:
- заболеваний надпочечников – сердечная декомпенсация, обезвоживание, усиление катаболизма белков;
- заболеваний почек – гломерулонефрит, поликистоз почек, нефросклероз, некроз канальцев;
- гиперемии надпочечников – непроходимость мочевыводящих путей).
Что я должен знать перед сдачей теста?
Специальной подготовки пациента не требуется.
Специальной подготовки к тесту не требуется.
Некоторые лекарства могут повлиять на результаты теста. Пожалуйста, сообщите своему врачу обо всех принимаемых вами лекарствах. Не прекращайте лечение по собственному желанию.
Время проверки составляет 1 рабочий день.
Для снижения уровня мочевины:
- избегайте тяжелых физических нагрузок;
- избегайте употребление пищевых добавок, содержащих креатин;
- употребляйте меньше белка;
- пейте больше воды;
- соблюдайте диету – употребляйте меньше мяса и птицы, но больше рыбы, орехов, овощей и фруктов, злаков, оливкового масла.
- ограничьте потребление соли;
- сократите потребление плохих жиров – насыщенных и трансжиров – они содержатся в обработанном мясе, в тортах, бисквитах и выпечке;
- не допускайте ожирения, ведите активный образ жизни.
Травяные препараты для снижения уровня мочевины:
- Пунарнава или бурхаавия раскидистая из семейства зонтичных. Это растение помогает избавиться от лишней жидкости в почках, уменьшая отек без каких-либо побочных эффектов.
- Каперсы колючие из семейства каперсовых. Препараты этого растения используют для расщепления камней в области почек и как лекарство от инфекции мочевыводящих путей. Эта трава помогает удалить элементы, блокирующие мочевыводящие пути, удаляет излишки жидкости
- Гокшура или Неринджил, или дьявольский сорняк – родина Индия. Это мочегонное средство. Также его используют в качестве травяного тонизирующего средства для восстановления клеток почек.
Добавить комментарийОтвет на отмену
Вы должны войти в систему, чтобы оставить комментарий.




Популярные записи и страницы
- Жировая болезнь печени – причины, симптомы, лечение и профилактика
- Сыпь на коже: как по высыпаниям определить, чем болеет человек
- Признаки низкого тестостерона у мужчин, которые нельзя игнорировать
- Онлайн калькулятор ХГЧ: расшифровка анализа бета-ХГЧ
- Анализ на креатинин. Норма, отклонения от нормы, их причины
- Задержка месячных при отрицательном тесте на беременность: причины, последствия, что делать
- Медикаментозный аборт — прерывание беременности без тяжелых последствий?
- Самые важные симптомы диабета. Как распознать первые симптомы заболевания?
- Гинекологические мазки на флору: как берут, что показывают, как расшифровываются
- Гастроэзофагеальная рефлюксная болезнь: новый подход к причинам и лечению
Недостаток аминокислот
Дефицит незаменимых аминокислот приводит к различным заболеваниям. Например:
- Дефицит валина приводит к гиперестезии и атаксии.
- Лейцина — к нарушению работы щитовидной железы.
- Изолейцина — к активному выводу из организма азота, к уменьшению массы тела.
- Фенилаланина — к нарушению работы щитовидки, надпочечников, к низкому артериальному давлению.
- Треонина — к массовому выделению азота и потере веса.
- Триптофана — к анемии, бесплодию, выпадению волос, проблемам с органами зрения, развитию пеллагры.
- Метионина — к ожирению, циррозу печени, анемии, мышечной атрофии.
- Лизина — к анемии, кровоизлиянием в глаза, плохому аппетиту, ферментным нарушениям, замедлению роста, нарушениям функциональности репродуктивной системы, снижению слуха.
- Аргинина — к азооспермии, нарушению роста.
При дефиците аминокислот могут наблюдаться следующие симптомы:
- гипертония;
- артрит;
- низкое половое влечение;
- бессонница;
- перепады настроения;
- низкий вес;
- неудовлетворительное состояние волос, ногтей, кожи.
Избыток аминокислот
Избыток аминокислот также не полезен для организма:
- Избыток аланина — усталость, снижение памяти и концентрации, проблемы со сном, мышечная и суставная боль, депрессия.
- Аргинина — тремор конечностей, раздражительность, снижение артериального давления, крапивница.
- Аспарагина — перевозбуждение нервной системы, сгущение крови, повышение тестостерона, аутизм у плода (при беременности).
- Валина — онемение конечностей, раздражительность, аллергия, проблемы с работой желудка и кишечника.
- Гистидина — нервные стрессы и психозы.
- Глицина — учащение сердцебиения, усталость, покраснение лица, повышенная активность.
- Глутамина — сгущение крови, тошнота, головные боли, сбой в работе печени, понижение концентрации гемоглобина, глаукома, заболевания почек и печени, развитие болезни Альцгеймера.
- Изолейцина — апатия, аллергия, сгущение крови, повышение концентрации аммиака.
- Метионина — сонливость, тошнота, аллергия.
- Тирозина — гипертония, учащение пульса, низкая температура тела, снижение мышечной массы.
- Фенилаланина — снижение памяти, нарушение деятельности нервной системы.
Какие продукты употреблять для поддержки баланса?
Общепринято, что аминокислоты содержатся в продуктах животного происхождения. Причина этого заключается в том, что аминокислотный профиль в продуктах животного происхождения более полный, чем в растительных продуктах. Но еще не так давно доминирование животных продуктов в рационе подвергалось критике. Дело в том, что мясо животных, выращенных на промышленных фермах, уступает по качеству мясу животных, выращенных в дикой природе. Что касается молочных продуктов, то большинство из них содержат добавки или вообще не являются натуральными.
Сегодня эксперты выделяют следующие полезные животные источники аминокислот:
- постная говядина;
- птица — грудка индейки и курицы;
- яйца;
- морепродукты, морская и речная рыба;
- натуральный йогурт, творог, молоко.
Следует отметить, что больше всего аминокислот содержится в мясе птицы и говядине. Самые важные аминокислоты содержатся в говядине и телятине; молочные продукты также содержат много аминокислот, но только если продукт натуральный. Морепродукты и рыбу не следует замораживать — продукты, которые долго хранились в холодильнике, теряют аминокислоты по сравнению со свежей рыбой.
Растительная пища также богата аминокислотами и ценными белками. Однако его количество ниже, чем в продуктах животного происхождения. Содержание лейцина в гречке, например, в 2-3 раза ниже, чем в мясе. Поэтому, чтобы получить суточную дозу этой аминокислоты, человеку придется съесть в 2-3 раза больше гречки, чем мяса. Поэтому вам не придется выбирать, животная и растительная пища не являются взаимоисключающими, их сочетание — идеальная диета для здорового человека.
Растительная пища, богатая аминокислотами:
- все виды бобовых — фасоль, соя, горох;
- крупы;
- макаронные изделия из муки грубого помола;
- ржаной хлеб;
- орехи;
- грибы;
- зелень — брокколи, шпинат.
Изучение аминокислот очень важно для диагностики и выбора лечения различных заболеваний. Результаты интерпретируются с учетом возраста пациента, его пищевых привычек, клинического состояния и других факторов. Чтобы исключить врожденные нарушения обмена веществ, в первые недели жизни ребенка необходимо провести анализ на содержание аминокислот. В этом случае врач может назначить специальные диетические и лечебные меры, чтобы предотвратить развитие отклонений в организме.








