Кислород постоянно пополняется в атмосфере Земли за счет фотосинтеза в растениях, цианобактериях и зеленых водорослях. По некоторым оценкам, зеленые водоросли и цианобактерии в морской среде обеспечивают около 70% свободного кислорода, производимого на Земле, остальная часть производится наземными растениями и деревьями.
Воздух
Химический состав. Воздух состоит из смеси примерно 27 различных газов. Около 99% составляет смесь кислорода и азота. Остальной процент составляют водяной пар, углекислый газ, метан, водород, озон и благородные газы (аргон, ксенон, неон, гелий и криптон).
Страница->Решение задач по химии содержит решения задач и заданий, включая решенные примеры по всем темам химии.
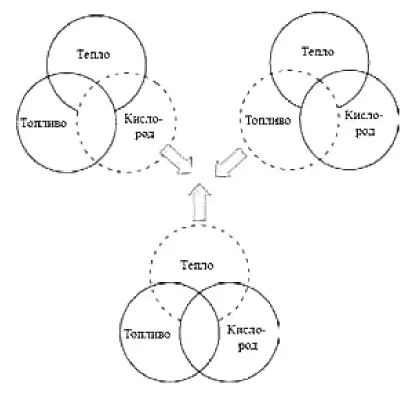
В повседневной жизни мы часто видим, как сгорают такие виды топлива, как газ, древесина и уголь. Знаете ли вы, что причиной горения является кислород в воздухе? При нагревании кислород вступает в сильную реакцию со многими веществами, выделяя тепло и свет. Эти реакции называются реакциями горения. Во время горения атомы простых веществ соединяются с атомами кислорода, образуя оксиды. Общая схема взаимодействия между простыми веществами и кислородом выглядит следующим образом
| простое вещество + кислород = оксид |
Горение — это химическая реакция, при которой вещество окисляется с выделением тепла и света.
Реакция между веществом и кислородом называется окислением, а их продукты — оксидами.
Оксиды — это композитные материалы, состоящие из двух элементов, один из которых — кислород. При сгорании вещества на воздухе образуется один и тот же продукт — оксид. Однако, поскольку кислород составляет примерно одну пятую часть кислорода в воздухе, вещество горит медленнее в воздухе, чем в кислороде.
Если раскаленный уголь (рис. 1) поместить в емкость, содержащую кислород O2раскаленный уголь (рис. 17а) светится белым светом и сгорает с образованием монооксида углерода (CO)2 (углекислый газ):.
| углерод — кислород = оксид углерода (IV) |
Чтобы определить, какое вещество образуется, в сосуд наливают известковую воду — она мутнеет. Это доказывает наличие углекислого газа.
Сера помещается в железную ложку, поджигается в пламени спиртовки и помещается в сосуд с кислородом. Сера S сгорает в кислороде O2 (рис. 17б), образуя оксид серы (IV) газ с сильным запахом (эксперимент проводится под электрическим током).
| сера + кислород = оксид серы (IV) |
Фосфор P сгорает в кислороде O2 в легком пламени, образуя белый дым, состоящий из частиц оксида фосфора (V) (рис. 17c): дым не воспламеняется.
| фосфор + кислород = оксид фосфора (V) |
вещества, которые обычно считаются невоспламеняющимися (рис. 17d). Железо также горит в кислороде. Если спичку поднести к тонкой стальной проволоке, она воспламенится и упадет в кислородный баллон, спичка также воспламенит железо. При горении железа происходит сильный взрыв искр, состоящих из капель расплавленного оксида железа, называемого Fe3O4. Реакция горения железа с кислородом может быть представлена следующим уравнением
| железо+кислород | железная окалина — (смесь оксидов железа) |
Другие металлы также могут взаимодействовать с кислородом, но эти реакции не всегда сопровождаются горением. При сильном нагревании меди с кислородом она превращается в черный порошок, оксид меди (II), не сгорая.
| медь — кислород | оксид меди (II) |
Медленное окисление
Когда вещество медленно реагирует с кислородом, постепенно выделяется тепло. Этот процесс известен как медленное окисление.
Это явление очень распространено. Например, при разложении (окислении) удобрений выделяется тепло, которое можно использовать в теплице.
Вещества, которые при сгорании выделяют большое количество тепла, называются топливом. На практике используются три вида топлива: твердое, жидкое и газообразное.
К твердым видам топлива относятся антрацит, каменный, бурый уголь, торф и жидкое топливо. Жидкое топливо включает бензин, парафин, топливо и другие промышленные газы.
Считается, что в чистом воздухе при нормальных условиях содержится 78,1% азота и 20,93% кислорода. Однако в зависимости от географического положения и высоты над уровнем моря состав воздуха может различаться.
Воздух, свойства и химический состав
Воздух — в основном смесь газов азота и кислорода — всего 98-99%, а также медленный, углекислый газ и водород, образующие атмосферу Земли.
Воздух, роль и значение воздуха:
Воздух — в основном смесь газов азота и кислорода — всего 98-99%, а также аргона, углекислого газа и водорода, которые также образуют атмосферу Земли.
В России определение воздуха дано в Федеральном законе от 04.05.1999 № 96-ФЗ «Об охране атмосферного воздуха».
Атмосферный воздух является важным компонентом окружающей среды и естественной смесью атмосферных газов за пределами жилых, промышленных и других помещений. Атмосферный воздух является важным компонентом окружающей среды и неотъемлемой частью среды обитания человека, растений и животных.
Воздух окружает планету Земля и образует ее атмосферу. Он удерживается на месте под действием земного притяжения. Атмосфера Земли создает давление, защищает жизнь на Земле благодаря наличию жидкой воды на поверхности планеты, поглощает вредное ультрафиолетовое излучение Солнца, задерживает тепло и нагревает поверхность (парниковый эффект) и уменьшает разницу температур в ночное время (суточная температурные изменения).
Воздух необходим для нормального существования жизни на Земле. Без воздуха жизнь человека была бы невозможна. Кислород является важной частью воздуха для человека. Кислород воздуха поступает в клетки организма во время дыхания и используется в процессах окисления, тем самым высвобождая энергию (метаболический, аэробный).
Если человек может прожить несколько недель без пищи и несколько дней без воды, то без воздуха он может прожить всего несколько минут (одна минута для простого человека, пять минут для хорошо подготовленного водолаза).
Общая масса воздуха на Земле составляет 5,13. 1015 т и оказывает среднее давление 1,0333 кг на см3 на уровне моря.
Свойства воздуха:
Воздух бесцветен, безвкусен и не имеет запаха. Она абсолютно прозрачна.
Воздух является сжатым и упругим.
Горячий воздух легче холодного. Воздух сжимается при охлаждении и расширяется при нагревании.
Воздух сохраняет тепло и почти непроницаем.
Он всегда заполняет весь объем и содержится там, где есть пустые места.
Воздух необходим для процесса горения.
Диоксид углерода (углекислый газ, CO2) — это бесцветный газ (при нормальных условиях) и почти без запаха (при высоких концентрациях появляется запах кислой соды — запах газированной воды). Концентрация углекислого газа в атмосфере составляет 0,0314% по объему и 0,046% по весу. Она примерно в 1,5 раза выше, чем в воздухе.
Воздух с точки зрения химии, его основные свойства
На нашем блоге мы много говорили о различных химических веществах и смесях, но еще не говорили об одном из самых важных сложных веществ — воздухе. Поэтому мы немного поговорим с вами о воздухе. В первой статье — краткий рассказ об исследовании воздуха, его химическом составе и ключевых элементах, относящихся к нему.

Сегодня воздух рассматривается как смесь газов, составляющих атмосферу нашей планеты. Однако так было не всегда. Долгое время ученые считали, что воздух — это просто материя, связная сущность. Многие ученые предполагали сложный состав воздуха, но не шли дальше вплоть до 18 века. Кроме того, воздух приобрел философское значение. В Древней Греции воздух считался одним из основных светских элементов и вместе с землей, огнем, почвой и водой составлял все сущее. Аристотель рассматривал воздух как потенциально светлый элемент, представляющий собой влагу и тепло. В своих трудах Ницше писал о воздухе как о символе свободы, как о самой высокой и тонкой форме материи, не имеющей преград.
В 17 веке было установлено, что воздух является материальной сущностью, веществом, свойства которого, такие как плотность и вес, можно измерить.
В 18 веке ученые проводили реакции воздуха с различными веществами в герметичных химических сосудах. Таким образом, они обнаружили, что примерно пятая часть объема воздуха поглощается, а оставшаяся часть не поддерживает горение или дыхание. В результате они пришли к выводу, что воздух — это сложная субстанция, состоящая из двух компонентов, один из которых, кислород, поддерживает горение, а другой, азот «испорченного воздуха», не поддерживает горение и дыхание при горении. Так был открыт кислород. Вскоре после этого азот был получен в чистом виде. Только в конце 19 века, постепенно, в воздухе появились солнце, подвалы, незнакомые люди, радон и неон.
Химический состав
Воздух состоит из смеси примерно 27 различных газов. Около 99% составляет смесь кислорода и азота. Остальной процент составляют водяной пар, углекислый газ, метан, водород, озон и благородные вещества (медленный, незнакомый, неон, солнечный, криптон). Например, в воздухе часто встречаются окись углерода, йод, оксиды азота и аммиак.

Считается, что чистый воздух содержит 78,1% азота и 20,93% кислорода. Однако в зависимости от географического положения и высоты над уровнем моря состав воздуха может меняться.
Также используется термин загрязненный воздух. Это относится к воздуху, состав которого отличается от естественного из-за присутствия загрязняющих веществ. К таким веществам относятся. -Природные источники (например, вулканические газы и пыль, морская соль, дым, газы, природные пожары, пыльца растений, пыль от эрозии почвы) -Анти антропогенные источники -Анти антропогенные источники, возникающие в результате промышленной и бытовой деятельности (уголь, сера, азот, уголь и другая добыча, промышленная пыль, сельскохозяйственные отходы, промышленные и бытовые отходы, аварийная нефть, другие экологические опасности, выхлопы автомобилей) (например, количества)
Свойства
Чистый атмосферный воздух бесцветен, не имеет запаха и невидим, но его можно почувствовать. Параметры естественного воздуха определяются следующими свойствами.

— масса — температура — плотность — атмосферное давление — влагосодержание — теплоемкость — теплопроводность — вязкость.
Большинство параметров воздуха зависит от температуры, и существует множество таблиц с параметрами воздуха для различных температур. Температура воздуха измеряется метеорологическим термометром, а влажность — гигрометром.
Воздух обладает окислительными свойствами (благодаря высокому содержанию кислорода), поддерживает горение и дыхание, слегка проницаем для тепла и особенно растворим в воде. Его плотность уменьшается при повышении температуры, а вязкость увеличивается.
В следующей статье вы найдете интересную информацию о воздухе и его использовании.
Ничто не влияет на формирование мира. Если вспомнить, что частью воздуха является кислород, то что бы случилось с Землей без него? Здания и сооружения рухнут.
Состав воздуха
Воздух необходим для дыхания всех живых организмов. Он состоит из азота, кислорода, аргона, углекислого газа и различных примесей. Состав окружающего воздуха может меняться в зависимости от условий и местоположения. Например, в городских районах уровень углекислого газа в воздухе выше, чем в лесных массивах, из-за обилия транспортных средств. В высокогорье уровень кислорода снижается, поскольку молекулы азота легче молекул кислорода. Следовательно, концентрация кислорода уменьшается быстрее.
В 1754 году шотландский физик и химик Джозеф Блэк экспериментально доказал, что воздух — это не просто вещество, а газовая смесь.

Рисунок 1.Джозеф Блэк.
Процентный состав воздуха показывает, что основным его компонентом является азот. На долю азота приходится 78% объема воздуха. Доля кислорода в молекулах воздуха составляет 20,9%. Азот и кислород — два основных компонента воздуха. Другие соединения значительно меньше и не превышают 1%. Например, аргон составляет 0,9 % по объему, а диоксид углерода — 0,03 % по объему. Воздух также содержит примеси, такие как неон, криптон, метан, соляр, водород и другие.
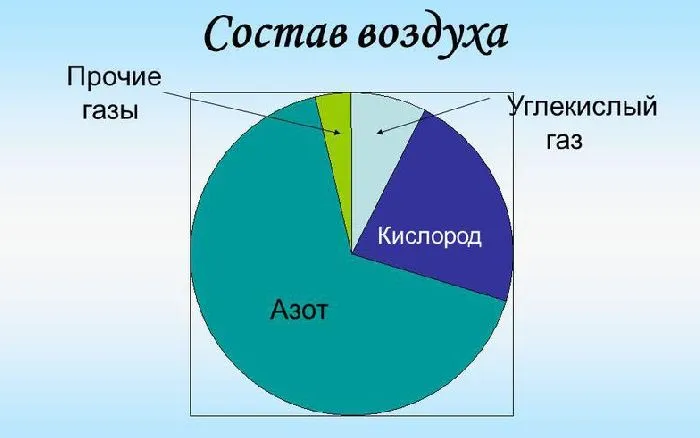
Рисунок 2.Состав воздуха.
В производственных помещениях аэродинамический состав воздуха очень важен. Отрицательно заряженные ионы в воздухе оказывают положительное воздействие на организм человека, заряжая его энергией и улучшая настроение.
Азот является самым важным компонентом воздуха. Перевод названия элемента «неживой» позволяет называть азот простым веществом, однако азот в связанном состоянии является одним из основных элементов жизни и входит в состав белков, нуклеиновых кислот, витаминов и т.д.
Азот — второй периодический элемент, у которого нет свободной орбитали и, следовательно, нет возбужденного состояния. Однако в основном состоянии азот может иметь валентности III и IV, поскольку ковалентные связи образуются по донорно-акцепторному механизму с участием неделимой пары электронов азота. Степень окисления, которую может представлять азот, варьируется в широких пределах от -3 до +5.
В природе азот встречается в виде простого вещества — газа N2 и в связанном состоянии. В молекуле азота индивиды связаны прочными тройными связями (энергия связывания 940 кДж/моль). При нормальной температуре азот может взаимодействовать только с литием. После предварительной активации молекулы путем нагревания, облучения или катализа азот вступает в реакцию с металлами и неметаллами.
Кислород
Кислород — самый распространенный элемент на Земле. Массовая доля коры Земли составляет 47,3%, массовая доля атмосферы — 20,95%, а массовая доля живых организмов — около 65%.
Почти во всех соединениях (кроме фтористых соединений и пероксидов) кислород имеет определенную валентность II и степень окисления; на втором внешнем уровне нет свободных орбиталей, поэтому нет условий для возбуждения кислородных персон. Как простое вещество, кислород существует в двух гомологичных формах: кислородный газ O2 и озон O3. Самым важным соединением кислорода является вода. Примерно 71% поверхности Земли состоит из воды, без которой жизнь была бы невозможна.
Озон образуется в природе из кислорода, содержащегося в воздухе во время грозы, а в лаборатории — путем пропускания электрических разрядов через кислород.

Рисунок 3.Озон.
Озон является еще более мощным окислителем, чем кислород. В частности, он окисляет золото и платину.
Кислород в промышленности обычно добывается путем сжижения воздуха, затем путем отделения азота выпариванием (существуют различия в температурах кипения. -183°C для жидкого кислорода и -196°C для жидкого азота).
Водород (как компонент воздуха) не играет заметной биологической роли. Незнакомцы — это инертные, одновибрационные газы без цвета, вкуса и запаха.
Воздух – друг человека

В повседневной жизни люди часто изобретают. Это происходит благодаря физическим свойствам атмосферного воздуха. Например, в древние времена его использовали для навигации. Ветер надувал паруса, и корабль мог двигаться в нужном направлении. С древних времен люди начали строить ветряные турбины, начало которым положило вращение плавников под действием атмосферных потоков.
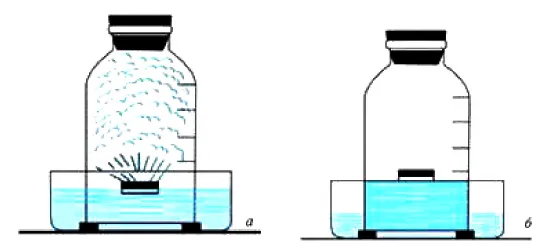
Физические свойства воздуха по-прежнему активно используются в современной промышленности. Хорошим доказательством этого является изобретение водолазного колокола, который может выполнять различные задачи под водой. Колокол опускается в воду, но из-за сопротивления воздуха кислород всегда остается в колоколе, как и в описанном выше эксперименте со стеклом. Это свойство позволяет людям спускаться на глубину без специального оборудования, но совершенно безопасно для здоровья. Эта технология часто используется для ремонта мостов, обследования и ремонта океанских и речных судов, а также для помощи водолазам на большой глубине.
Сегодня человечество нашло множество применений воздуху в повседневной жизни. Используется для накачки шин, промывки древесного угля, уборки пыли и небольших пыльных помещений.