Его можно назначать в сочетании с другими лекарственными средствами, например, в сочетании с менопаузальной гормональной терапией. Согласно результатам многолетнего применения, Melsmon не имеет побочных эффектов благодаря своей высокой эффективности.
Митохондрии — нечто большее, чем «фабрики энергии»

Митохондрии — это универсальные клеточные организмы, встречающиеся почти у всех эукаринов (организмов, клетки которых содержат ядро). Они важны, поскольку вырабатывают энергию в виде АТФ и обеспечивают различные функции клеток (и организма в целом). По этой причине их часто называют «электростанциями» или «электрогенераторами».
Однако митохондрии — это нечто большее, чем «энергетические станции». В конце концов, именно этому внутриклеточному виду, который мы сейчас наблюдаем, мы обязаны огромным биоразнообразием таких крупных животных и растений. Митохондрии являются неотъемлемой частью клетки, но в теории они должны происходить от бактерий. Примитивные клетки (принцы), плененные у бактерий, могут использовать кислород для получения энергии, что очень важно для поддержания крупных генетических механизмов (для эволюции). Однако, несмотря на миллиарды лет сплоченности, митохондрии сохранили многие характеристики независимых организмов. У него есть собственная ДНК и даже собственные рибосомы, которые производят синтез белка.
Количество митохондрий в клетке широко варьируется в разных органах и типах тканей. В одной клетке может быть от миллиона до нескольких миллионов митохондрий. Например, митохондрии составляют 10% от массы человека, но для определенных тканей и энергетических устройств эта доля может достигать 40%.
Не все клетки одинаковые
Клетки могут быть «структурными элементами» многоклеточных организмов и всего организма в целом. За некоторыми исключениями, почти все клетки содержат генетический материал (ДНК и РНК), который регулирует метаболизм и синтез белка. Однако не все организмы устроены одинаково. Поэтому на основании различий в клеточной организации выделяют две группы: эукарии и протисты.
Растения, животные и грибы являются эукариотами и имеют клетки более высокого уровня. Их генетический материал сосредоточен в центральном ядре, окруженном специализированными клеточными компонентами, называемыми органами. Такие организмы, как митохондрии, крупные везикулярные сети и аппарат Гольджи, действуют как хорошо смазанные каретные ремни. Одни вырабатывают энергию, другие составляют и упаковывают белки, третьи транспортируют их в различные части клетки. Ядро, как и большинство эукариотических органов, связано с мембранами, которые регулируют вход и выход белков, ферментов и других клеточных материалов в ткани и из них.
С другой стороны, жрецы — это одноклеточные организмы, такие как бактерии и древние Прокариотические клетки имеют меньшую структуру, чем эукариотические. У них нет ядра. Напротив, их генетический материал свободно витает внутри клетки. У них нет многих мембранных органелл, которые есть в эукариотических клетках, включая митохондрии.
«Митос» и «хондрос»
В обзоре истории митохондрий, опубликованном в журнале Cell Biology в 1981 году, авторы Ларс Эрнстер и Готфрид Шац отмечают, что первое реальное наблюдение митохондрий было сделано Ричардом Альтманом в 1890 году. Бенда в 1898 году. Оно происходит от двух греческих слов, mitos и chondros, означающих нить и зерно. Дело в том, что митохондрии адаптируются к количеству энергии, которую они получают и потребляют. Они делают это (образуя цепочку) и участвуют в разделении. При недостатке поступающей энергии они сливаются, при избытке — делятся и используют ее. Длительная фрагментация и длительное слияние влияют на качество митохондрий клетки с точки зрения их функциональности.
Здоровые циклы деления и слияния («динамика митохондрий») являются ключом к здоровью клеточного метаболизма.
5. Fu Q., Mittnik A., Johnson P.L., Bos K., Lari M., Bollongino R., Sun C., Giemsch L., Schmitz R. A modified timescale for human evolution based on ancient mitochondrial genomes. Текущая биология. 2013 Mar 21;23(7):553-59.
Клеточные «электростанции»
Большая часть энергии человеческого тела генерируется внутри отдельных клеток. Каждый из них отвечает за собственное энергоснабжение. Это означает, что каждой клетке (по крайней мере, тем, у которых есть ядро, не считая эритроцитов) нужна своя «электростанция». И это действительно так! Более того, часто существуют десятки или даже сотни «электростанций». Их количество зависит от того, насколько интенсивно функционируют клетки и, следовательно, от количества энергии в единицу времени. По-научному эти «электростанции» называются митохондриями, а их совокупность — митохондриальным резервуаром клетки.
Термин «митохондрии» происходит от сочетания двух греческих слов «митос», что означает «нить» или «волокно», и «хрящ», что означает «зерно» или «крупа». Конечно, это название совсем не отражает функцию митохондрий. Это связано с тем, что впервые они были описаны в 1850 году. Исследователи видели четко очерченные включения в цитоплазме, четко очерченные в мышечных клетках. Их внутренняя структура также состояла из нескольких полос и точек. Но в то время никто не знал, что это такое и зачем оно нужно, поэтому название было дано только по внешнему виду. А понимание решающей роли митохондрий в отношении наших клеток и нашего тела возникло ровно век спустя, в 1948 году.
Как появились митохондрии?
Один из ключевых вопросов, который давно волнует научное сообщество: откуда берутся наши клетки? Самые современные и надежные теории предлагают очень необычный ответ. Митохондрии произошли от бактерий.
Давным-давно моноцитарные организмы, ставшие нашими предками, научились поглощать крошечные бактерии, присутствующие в окружающей среде. Проще говоря, они питались. Однако однажды такие рантье не были уничтожены при попадании во внутриклеточную среду. Более того, они сохранили не только свою целостность, но и некоторые свои функции. В частности, их способность использовать кислород для получения энергии. Позже мы пришли к эволюции, до того, как энергия стала малоизвестной. Однако можно с уверенностью сказать, что аэробный путь, предложенный бактериями, безусловно, более выгоден и эффективен.
Результатом этого замечательного события стал внутриклеточный симбиоз. Бактерия вырабатывала много энергии, а одноклеточный организм-хозяин снабжал ее достаточным количеством кислорода и других необходимых соединений. Со временем протобактерия была упрощена и модифицирована и стала важной клеточной органеллой. Это партнерство оказалось настолько успешным, что теперь он питает почти все эукариотические клетки растений, грибов и животных. 1, включая вашу и мою.
Как устроены митохондрии?
Многое в структуре митохондрий до сих пор напоминает нам о том, что когда-то они были самостоятельными бактериями. Например, они окружены внешней липидной мембраной — такой же мембраной, которая имеется во всех других клетках нашего организма. Основная функция внешней мембраны заключается в защите митохондрий, изоляции их от внутриклеточной среды и транспортировке необходимых веществ внутрь и наружу2.
Матка занимает внутреннее пространство митохондрий. Это жидкая среда, состоящая из смеси жирных кислот, белков, рибосом и других соединений. Первый этап кислородного дыхания, т.е. выработки энергии, происходит в матке. Кроме того, здесь же находится и другой элемент прежней митохондриальной автономии — митохондриальная ДНК. Да, оказывается, не весь наш генетический материал находится в ядре клетки! Эти маленькие круглые митохондриальные ДНК (мтДНК) кодируют 13 белков, которые необходимы для функционирования самих митохондрий. В основном это ферменты, участвующие в дыхательной цепи окисления водорода3.
И что самое интересное, люди наследуют мтДНК только от своих матерей, а мтДНК, полученная из спермы, уничтожается сразу после оплодотворения.4 Эта «женская» мтДНК мутирует по очень точным критериям, что позволяет нам точно определить, как она изменилась со временем. Несколько последних исследований ясно показали, что около 200 000 лет назад в Африке жила женщина, от которой все современные люди получили свою мтДНК. Ученые дали этой женщине поэтическое название «Митохондриальная Ева».
Наконец, между наружной мембраной и маткой находится второй эндометрий. Она имеет неправильную форму и образует кристы — длинные складки, направленные к центру митохондрии. Они были замечены первыми исследователями в 19 веке — в виде темных полос. Энергия в виде молекул аденозинтрифосфата (АТФ) хранится во внутренней мембране. На этот процесс расходуется более 80% кислорода, поступающего в кровь во время дыхания6.

В кишечнике человека обитает множество бактерий. Среди них есть союзники, которые помогают иммунной системе распознавать патогенные микроорганизмы. Эти кишечные бактерии взаимодействуют с митохондриями, а также с клетками иммунной системы.
Митохондрии: как всё устроено
Митохондрии состоят из двух мембран: внешней, которая пропускает ионы и некоторые белки, и внутренней, ограничивающей матку, внутреннее пространство митохондрий. Пространство между мембранами называется межмембранным пространством (МПМ). Эндометрий образует множество выступов (называемых кристами). В матриксе митохондрий содержатся ферменты цепи Кребса, а во внутренней мембране митохондрий — четыре белковые цепи: дыхательная цепь (система переноса электронов, ETC) и АТФ-синтаза (рис. 1). Митохондрии также содержат подвижные элементы дыхательной цепи: убихинон во внутренней мембране и цитохром c в ММП. Принцип работы дыхательной цепи заключается в окислении субстратов из цепи Кребса и переносе электронов от этих субстратов к конечному получателю, кислороду, через кофактор ETC. Существует определенная закономерность в последовательности переноса электронов. Электроны исходят от доноров с более отрицательным окислительно-восстановительным потенциалом* (EРыжий/корова.) к получателю с более положительным значением EРыжий/корова.(E). Таким образом, кажется, что электроны движутся вниз (рис. 2). Во время переноса электронов определенные комплексы дыхательной цепи перекачивают протоны из матрикса в ММП, создавая электрохимический потенциал во внутренней мембране митохондрий. Он используется для синтеза АТФ (рис. 1)2.
*Редокс-потенциал является синонимом окислительно-восстановительного потенциала (от восстановления и окисления).
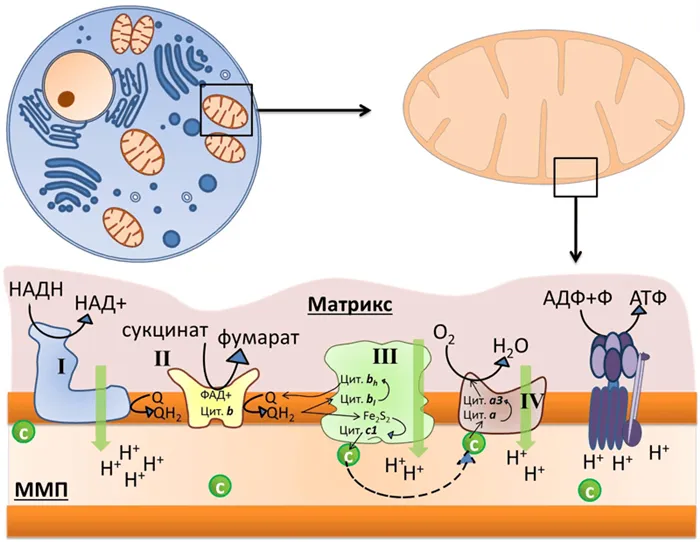
Рис. 1.Внутренняя мембрана митохондрий содержит локализованные комплексы дыхательных цепей: i — НАДН-дегидрогеназа, ii — сукцинатдегидрогеназа, iii — цитохромный комплекс b-c1 или цитохром-редуктаза c, iv — цитохром или цитохром и фермент-синтаза АТФ. Q — это убихинон, зеленый кружок «с» — цитохром с. Черные стрелки указывают на перенос электронов, пунктирные стрелки — на диффузию цитохрома c из комплекса III в IV, а зеленые стрелки — на перенос протонов.
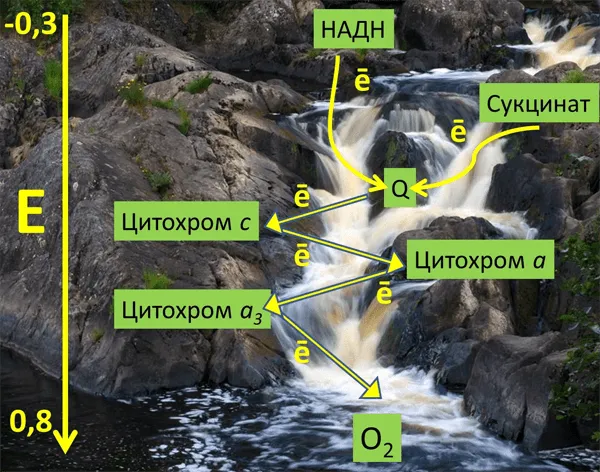
Рисунок 2. Образное представление окислительно-восстановительного потенциала средних точек различных митохондриальных переносчиков энергии ЭТЦ (вольт) на фоне реки Тохмайоки в Карелии.
Ведущие ученые, такие как Кребс, Митчелл, Реннингер, Чанс и Сухрачев, занимались митохондриями, но благодаря тому, что мы много знаем об этих клеточных органеллах, многие митохондриальные процессы и свойства транспортеров электронов еще не изучены. В основном это связано с отсутствием подходящих неинвазивных методов. В этом году наша лаборатория в сотрудничестве с коллегами с других факультетов МГУ, Дании и Германии разработала методику селективного изучения образования цитохрома c непосредственно в живых митохондриях9.
Что такое конформация гема и почему она важна?
Более пристальный взгляд на комплекс дыхательной цепи (рис. 1) показывает, что три из них являются цитохромами — белками, содержащимися в крови, которые являются кофакторами, участвующими в системе переноса электронов. Другой цитохром диффундирует в ММП. Всего в митохондриях имеется три цитохрома: a, b и c. Они очень похожи и отличаются только боковыми корнями (рис. 3).
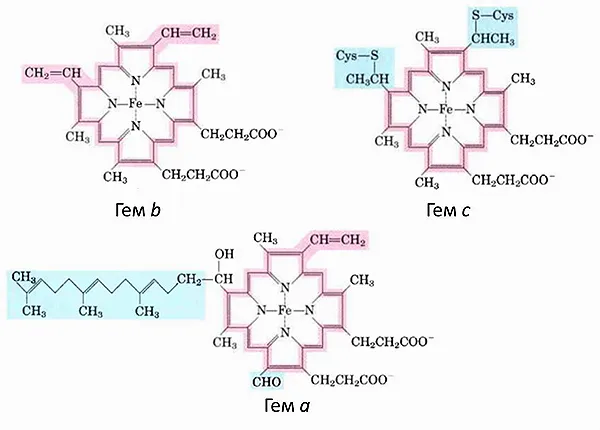
Рисунок 3: Различные типы цитохромных гемов. Каждый гем состоит из четырех пятичленных циклов, содержащих азот, которые связаны между собой. Это так называемые порфирины. Атомы азота координируют атомы железа (Fe). Группы крови имеют разные боковые группы, и только один тип крови ковалентно связан с белком. Рисунок из 2.
Во время переноса электронов изменяются окислительно-восстановительные условия цитохрома Fe 3+ /Fe 2+ гема, что приводит к изменению общего образования гема. Эти два параметра (eРыжий/корова. и композиция) всегда связаны друг с другом. Кроме того, изменения в белковом окружении также приводят к изменениям в образовании гемов 10 и 11.Рыжий/корова. определяет эффективность переноса электронов. Тип гема имеет большое значение. Кроме того, для переноса электронов от одного цитохрома к другому, бедра этих сайтов должны находиться на определенном расстоянии друг от друга и быть правильно ориентированными (рис. 4). Поэтому изменения в цитохромах могут влиять на эффективность транспорта электронов, то есть на функцию всей дыхательной цепи и, следовательно, на энергообеспечение клетки12, 13.
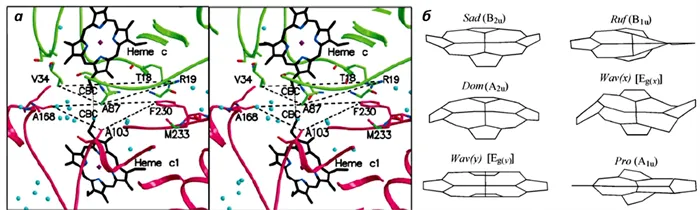
Рис. 4. a. Расположение цитохромов C и C1 во время транспорта электронов. b. Различные конфигурации цитохромного гема. 12 и 13 элементы.
CyatoChrom C является наиболее интересным в этом отношении. Он является единственным мобильным электронным переносчиком, который перемещается к ММП (поскольку все остальные цитокины закреплены в комплексе ЭТЦ) и поэтому наиболее чувствителен к изменениям, которые могут происходить в митохондриях. Кроме того, высвобождение цитохрома c запускает реакцию, которая приводит к апоптозу, и его окислительно-восстановительный потенциал также важен в этом процессе14.
Возникает вопрос. Какой состав и какие редокс-состояния митохондриального цитохрома c гема можно понять?
Как увидеть конформацию гема и оценить ЕРыжий/корова.?
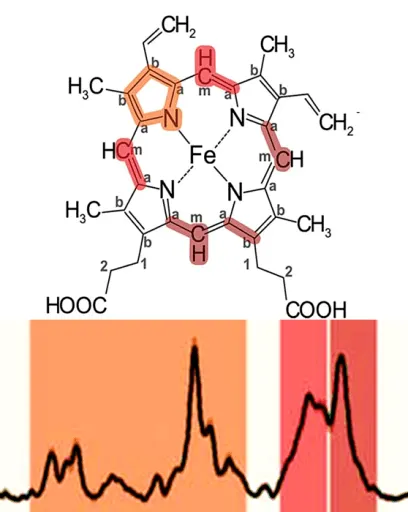
Рисунок 5.Вверху — эритроцит группы В. Внизу — долина эритроцитов. Различные группы и соответствующие им пики отмечены одинаковым цветом. Рисунок 20.
Можно определить элемент eРыжий/корова. Использование электрохимических методов. Однако для этого интересующий комплекс дыхательных цепей изолируют и помещают в совершенно разные условия окружающей среды, которые могут независимо изменять его свойства. Благодаря таким мощным методам, как структурный анализ ЯМР и рентгеновский анализ, можно определить состав белка и со-комплексов дыхательной цепи в окисленной и избранной формах. Однако нас также интересует их состояние в наиболее естественных условиях и доля этих ситуаций, в которых работает дыхательная цепь. Существует несколько неинвазивных методов определения редакционного состояния цитохромов. Например, абсорбционная спектроскопия. Митохондриальный спектр поглощения — это суммарный спектр всей цитоплазмы, имеющейся в митохондриях, а также митохондрий. Однако, поскольку все типы цитом очень похожи и поэтому имеют сходные спектры поглощения, трудно оценить вклад различных цитоплазм из-за постоянно меняющегося окислительно-восстановительного состояния при нормальном функционировании дыхательной цепи. Спектр 15.
Спектры флуоресценции НАДН и ФАД+ дают представление о редокс-состоянии только комплексов I и II. И мы можем определить работу только 16 митохондрий, от потенциала до внутренней митохондриальной мембраны.
Непосредственная информация о составе и окислительно-восстановительном состоянии цитохрома c в интактных (тотальных и функциональных) митохондриях является очень сложной задачей. Это связано с тем, что его состав постоянно меняется во время работы ЭТК и его взаимодействия с мембраной. Существование способа сделать это значительно расширит наши знания о влиянии цитохрома c на дыхательную активность и его вкладе в митохондриальную патологию.
Основная функция этих клеточных органелл — обеспечение энергией всех клеточных процессов. Но помимо этого, митохондрии выполняют множество других важных функций. Между ними: в
Митофузины – не просто какие-то белки
На молекулярном уровне слияние митохондрий представляет собой двухэтапный процесс, требующий координированного слияния внешней и внутренней мембран в отдельных последовательных событиях. У млекопитающих этот процесс регулируется тремя белками, которые являются ГТФазами; Mfn1 и Mfn2 необходимы для слияния наружной мембраны, а OPA1 — для слияния внутренней мембраны. Другие белки, Fis1 и Drp1, необходимы для слияния.
Роль белков митофузина была изучена в исследованиях потери и приобретения функции. Мыши с мутациями в белке митофузин умирают в середине беременности, поскольку слияние митохондрий становится невозможным. Митофагия важна для процессов аутофагии и митофагии. Снижение экспрессии Mfn2 в кардиомиоцитах предотвращает наступление аутофагии, поскольку предотвращает аутофагию и слияние лизосом. Истощение Mfn2 приводит к снижению мембранного потенциала митохондрий — чтобы компенсировать это, дыхательная цепь уменьшается, поглощение глюкозы увеличивается, а синтез гликогена снижается. Клетки подвергаются анаэробному гликолизу, и это путь к дегенерации раковых клеток. Дефицит Mfn2 вызывает нейродегенеративные изменения. Повышенная экспрессия Mfn2 в скелетных мышцах увеличивает чувствительность к инсулину.
Mfn1 имеет аналогичную функцию, но, возможно, в других тканях (экспрессия Mfn2 и Mfn1 отличается в разных тканях) — Mfn1 больше экспрессируется в сердце, печени, поджелудочной железе и семенниках, в то время как Mfn2 больше экспрессируется в сердце, скелетных мышцах, мозге и бурой жировой ткани. Таким образом, митофузин является важным регулятором динамики митохондрий. Экспрессия митофузина варьирует между органами и обеспечивает механизм адаптации к биоэнергетической эффективности и доступности питательных веществ, от которых зависит судьба клеток. Неудивительно, что белки слияния митохондрий являются потенциальными мишенями для фармакологического вмешательства2, 5.
Гипоталамус, митохондрии, метаболическая дисфункция и старение
Динамика митохондрий важна для всех клеток. В бета-клетках поджелудочной железы митохондрии являются датчиками питательных веществ и генераторами сигналов синтеза инсулина; в мышцах динамика митохондрий важна, например, для регуляции метаболизма глюкозы. Однако человек — это не набор различных типов клеток, каждый из которых принимает независимые решения. Организм — это система с центральным регулятором гомеостаза энергии и глюкозы. Этот центральный регулятор — гипоталамус.
Гипоталамус расположен в середине головного мозга и обеспечивает взаимосвязь нервной и человеческой регуляторных систем. Нейроны гипоталамуса распознают, обрабатывают и отвечают на сигналы от жировой ткани (лептин), поджелудочной железы (инсулин) и другие гормональные стимулы (например, грелин, холецистокинин, панкреатические полипептиды). Гипоталамус контролирует деятельность эндокринной системы человека, поскольку его нейроны могут выделять нейроэндокринные передатчики, стимулирующие или подавляющие выработку гормонов гипофизом. Другими словами, гипоталамус весит менее 5% мозга и играет центральную роль в регуляции эндокринной функции и поддержании гомеостаза во всем организме.
Еще Диллман (Dillman V.M. «The Great Biological Clock») отметил первостепенную роль гипоталамуса в систематическом развитии метаболической дисфункции, приводящей к ожирению, диабету, сердечно-сосудистым заболеваниям, раку и старению. Согласно теории переадаптации Диллмана, чувствительность рецепторов гипоталамуса к сигналам от тканей организма (например, лептину, инсулину) постепенно снижается с возрастом. Для запуска «ответа» требуется все больше и больше гормонов — больше инсулина, больше лептина. Развивается резистентность к инсулину и лептину, а метаболические заболевания приводят к старению и смерти.
В зависимости от функции, которую они выполняют, группы нейронов группируются в ядре гипоталамуса. Один из них, ядро дуги, является важным регулятором пищевого поведения и метаболизма. Могут существовать аппетитные (стимулирующие аппетит) и возбуждающие аппетит (подавляющие аппетит) нейропептиды, принадлежащие нейронам AGRP и POMC соответственно. Периферические сигналы (например, инсулин, грелин, лептин) влияют на экспрессию пептидов, которые стимулируют или подавляют аппетит, тем самым обеспечивая постоянство центральной регуляции (рис. 5).
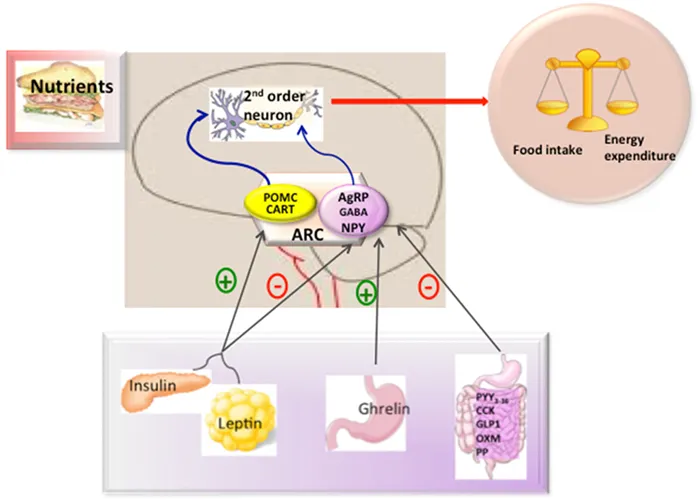
Рисунок 5.Амбулаторный контроль энергетического метаболизма пациента. Мозг воспринимает метаболические сигналы (лептин, инсулин, грелин и PYY3-36) от периферических тканей, таких как поджелудочная железа, жировая ткань и желудок. В мозге специализированные нейронные сети координируют адаптивные изменения в потреблении пяти видов пищи и затратах на нее.
Так кто и как регулирует чувствительность нейронов гипоталамуса?
Исследования динамики митохондрий в тканях мозга показывают, что динамика митохондрий играет важную роль в способности гипоталамических нейронов контролировать уровень глюкозы и энергетический гомеостаз в организме.
В нейронах AGRP, стимулирующих аппетит и регулирующих набор веса, подвески ведут к митохондриям, а питание высоким содержанием жиров — к их слиянию. Это означает, что реакция митохондрий отличается от реакции большинства других клеток.
Слияние этих нейронов модулирует их электрическую активность в ответ на высокожировую диету, стимулируя выработку пептидов аппетита (AGRP-пептидов), которые необходимы для набора веса и отложения жира в перегрузочном компоненте. Удаление MFN1 и MFN2 в этих нейронах снизило циркулирующий уровень лептина, что привело к меньшему набору веса у крыс.
Нейроны ROMS имеют противоположные функции, и динамика их митохондрий различается в ответ на потребление питательных веществ. Снижение экспрессии митопсина в этих нейронах приводит к нарушению связи митохондрий с ЭПС, что приводит к перееданию, лептинорезистентности и ожирению. В то же время увеличилось потребление пищи и снизились энергетические затраты.
Таким образом, реакция организма на высокожировую диету зависит от критериев динамики митохондрий в нейронах гипоталамуса. Ремоделирование митохондрий в нейронах обеспечивает реакцию на питательные вещества, стимулирует или подавляет аппетит и стимулирует выработку нейроперитонита, который влияет на метаболизм организма (рис. 6).
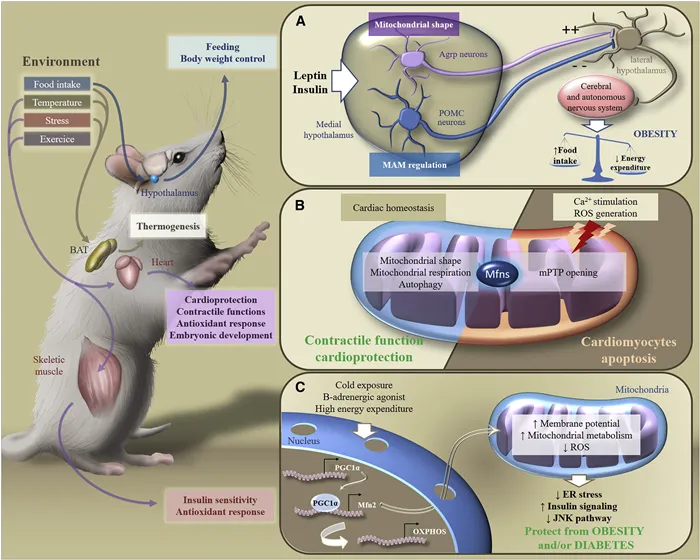
Рисунок 6. 2 Метаболическая адаптация к стимулам окружающей среды от
В ответ на внешние стимулы Мфн участвуют в переключении метаболической сигнализации в различных органах и обеспечивают поддержание системного энергетического гомеостаза. В частности, в ответ на потребление пищи, изменение температуры, стресс или физические нагрузки коричневая жировая ткань, мозг, сердце или скелетные мышцы регулируют свой метаболизм для контроля питания, массы тела, сократительной функции, антиоксидантной реакции или чувствительности к инсулину.
До сих пор не существует надежного и доступного теста для оценки митохондриального здоровья неспециалистами, хотя исследователи пытаются изобрести такой тест. Однако есть два метода, которые дают общее представление о том, насколько хорошо они работают, говорит Екатерина Зворыкина, биофизиолог и исследователь из Университета 2035.
Митохондрии и психика
Когда мышь испытывает психологический стресс, ее Т-клетки активизируются, а митохондрии фрагментируются, как будто ее организм имеет дело с вирусом. Когда вы создаете мышей, чьи Т-клетки постоянно активны, а митохондрии фрагментированы, они становятся тревожными, вялыми, невнимательными и немотивированными. И это типичные симптомы депрессии. Это ставит перед учеными новый вопрос: что если митохондрии являются причиной проблем с настроением у человека?
Чтобы проверить гипотезу, исследователи заставили крыс соревноваться друг с другом за социальную иерархию. Животные с более низким уровнем стресса заняли доминирующее положение. Затем исследователи изучили митохондрии в мозге соседних крыс — части мозга, которая регулирует эмоции и поведение как у грызунов, так и у людей. Было показано, что митохондрии функционируют хуже у инвазированных крыс. У них также меньше белков для преобразования кислорода и глюкозы в энергию. Это означает, что митохондрии не имеют оборудования для эффективного функционирования. Оказалось, что это различие является врожденным.
Неизвестно, делают ли врожденные особенности митохондрий нас, людей, такими же тревожными и депрессивными, как грызунов. Однако человеческие митохондрии реагируют на стресс таким же образом. Например, в одном эксперименте люди испытывали тревогу. Их обвиняли в краже или нарушении правил дорожного движения и заставляли придумать стратегию защиты в течение двух минут. Количество митохондриальной ДНК в крови участников увеличилось, и, как и у мышей, активизировался иммунный ответ.
Основной причиной плохого здоровья митохондрий является окислительный стресс, когда в организме слишком много реактивных видов кислорода. Лекарства от митохондрии до сих пор не существует. Однако вы можете помочь им, скорректировав свой образ жизни. Ниже приводится основной доклад биохимика и биоконсерватора Екатерины Щербаковой, научного сотрудника Центрального института биохимии и технологии и автора книги «Биохимическое питание».
Ограничить калории
Мы едим, чтобы питать наши митохондрии. И для них имеет значение, сколько мы едим. Ограничение калорий — единственная диета, которая безоговорочно продлевает продолжительность жизни экспериментальных организмов, от дрожжей и мух до грызунов и обезьян. Воспаление уменьшается, активируется аутофагия. Это естественный процесс, который избавляет клетки от «клеточного мусора». Митохондриальная аутофагия, митофагия, также активируется, и мертвые митохондрии удаляются.
В то же время повышается уровень нейротрофического фактора мозга (BDNF), способствующего образованию новых нейронов и синапсов. В результате ограничение калорий замедляет гибель нейронов у животных с болезнями Хантингтона, Альцгеймера и Паркинсона. Она также снижает частоту возрастных заболеваний, таких как рак, диабет и болезни сердца.
Почему это так; Молекулярные преимущества ограничения калорий многочисленны. Например, он восстанавливает уровень глутатиона, одного из основных клеточных антиоксидантов, и кофермента NAD+, который помогает преобразовывать питательные вещества в энергию. Голодание также активирует сиртуины. Эти белки выполняют две функции. Во-первых, они инактивируют гены, которые не должны использоваться клеткой во время голодания. Во-вторых, они участвуют в восстановлении повреждений ДНК, в том числе вызванных реактивными видами кислорода.
Для получения здоровых митохондрий нет необходимости голодать. Достаточно 25% снижения ежедневного потребления калорий. Это было сделано в американском исследовании здоровых людей с избыточным весом. Например, женщины съедали 1650 ккал вместо 2200 ккал. Это меньше, чем обычно, но не настолько, чтобы они проголодались. Через шесть месяцев у участников эксперимента было меньше повреждений митохондриальной ДНК. Митохондрий стало больше, и они начали функционировать более эффективно. Ученые наблюдали аналогичные эффекты у мышей от голодания через определенные промежутки времени.
Почему голод помогает митохондриям? С точки зрения организма, клетка находится в зоне риска. Она направляет всю свою энергию на производство энергии. Это активирует восстанавливающие ферменты, которые являются антиоксидантными защитными ферментами. В результате увеличивается как количество, так и эффективность работы митохондрий.
Кормить митохондрии витаминами и антиоксидантами
Простого ограничения калорий недостаточно. Митохондриям необходимы витамины, микроэлементы и антиоксиданты.
- Витамины группы В нужны митохондриям для работы белков, связанных с производством АТФ. Если питаться разнообразно и есть мало переработанных продуктов и много цельных, этих витаминов в организме будет достаточно.
- Коэнзим Q10 незаменим в процессе синтеза АТФ. Природные источники — мясо, рыба.
- Кверцетин также помогает митохондриям: это природный антиоксидант, который нейтрализует активные формы кислорода. Исследование на человеческой клеточной линии показало, что он повышает биогенез митохондрий внутри клеток — то есть в клетке их становится больше. Ищите кверцетин в красном луке, укропе и ягодах.
- Ресвератрол (тот самый антиоксидант, который якобы делает полезными вино и шоколад) продлевает жизнь дрожжам, червям и мухам. При этом он активирует сиртуин — белок, который делает полезным ограничение калорий. Из-за этого ресвератрол даже называют «миметиком голода»: в организме он включает те же механизмы, что активируются при голодании. Еще ресвератрол усиливает биогенез митохондрий. Лучше ищите его в винограде, чернике и арахисе, а не в вине и шоколаде.
Учитывая, что здоровье митохондрий в конечном итоге влияет на общее состояние здоровья, первые признаки митохондриальной дисфункции могут быть самыми разными.
Содержание
Согласно теории симболии, митохондрии возникли в результате оккупации бактериями примитивных клеток (прокариотов). Клетки, которые не могли использовать кислород для производства энергии, были сильно ограничены в своей способности расти. Бактерии (клетки-предшественники), с другой стороны, были способны расти. В процессе развития таких отношений предковые организмы передали многие из своих генов нынешнему эукариотическому ядру. И образовалась она благодаря повышению энергоэффективности. 1 Именно поэтому современные митохондрии больше не являются самостоятельными организмами. Их геномы кодируют компоненты собственной системы синтеза белка, но многие ферменты и белки, необходимые для их функционирования, кодируются хромосомами, которые синтезируются в клетке, а затем переносятся в органы.
Митохондрии были впервые обнаружены в виде гранул в мышечных клетках в 1850 году. Количество митохондрий в клетке не является постоянным. Их количество особенно велико в клетках, которые очень нуждаются в кислороде. Структурно они представляют собой цилиндрические органеллы, встречающиеся в эукариотических клетках в количестве от нескольких сотен до одной-двух тысяч и занимающие 10-20% внутреннего объема. Митохондрии также сильно различаются по размеру (1-70 мкм) и форме. Амплитуда этих органелл относительно постоянна (0,5-1 мкм). Они могут менять форму. В зависимости от того, какая часть клетки в данный момент потребляет больше энергии, митохондрии могут перемещаться по цитоплазме к местам наибольшего потребления энергии, двигаясь вместе со структурой цитоскелета эукариотической клетки.
Альтернативой большому количеству различных мелких митохондрий, работающих независимо друг от друга и обеспечивающих АТФ в небольших участках цитоплазмы, является наличие длинных разветвленных митохондрий, каждая из которых может обеспечивать энергию вдали от других участков клетки (например, моноциты, зеленая куриная хлорелла). Вариантом этой широко распространенной системы является упорядоченная пространственная ассоциация многих митохондрий (хрящ или митохондрии), которая обеспечивает их совместное функционирование и встречается как в моноцитах, так и в многоклеточных организмах. Этот тип хряща особенно сложен в скелетных мышцах млекопитающих, где группы гигантских разветвленных митохондрий связаны с алмазными контактами (IMCs). Последние образуются в тесном прикреплении между внешними мембранами митохондрий, а мезомембранное пространство в этой зоне приводит к увеличению электронной плотности. ГМК особенно многочисленны в кардиомиоцитах и связывают множество отдельных митохондрий в координированную совместную систему.
Митохондриальная ДНК, обнаруженная в матке, представляет собой замкнутую кольцевую двухпропеллерную молекулу, в клетках человека 16569 пар нуклеотидов, что примерно в 10-5 раз больше, чем в ДНК, находящейся в ядре. В целом, митохондриальная ДНК кодирует две рРНК, 22 ТНК и 13 ферментов дыхательной цепи, что составляет менее половины всех белков в ней. В частности, семь субъединиц АТР-синтетазы, три субъединицы цитохромной оксидазы и одна субъединица убицинол-С-ритма кодируются под контролем митохондриального генома. Все тРНК, кроме одной, двух рибосомных и шести тРНК транскрибируются тяжелой (внешней) нитью ДНК, а 14 других тРНК и один белок транскрибируются легкой (внутренней) нитью.
В связи с этим митохондриальный геном значительно больше и может достигать 370 000 пар нуклеотидов. Другими словами, он примерно в 20 раз больше, чем описанный выше митохондриальный геном человека. Количество генов также примерно в семь раз больше, что сопровождается дополнительными электронными путями в митохондрии растений, которые не связаны с составом АТФ.
Митохондриальная ДНК реплицируется в промежуточной фазе, которая частично синхронизирована с репликацией ядерной ДНК. Однако во время клеточного цикла митохондрии делятся на две части через промежуточную фазу, и их формирование начинается в кольцевой бороздке внутренней мембраны митохондрий. Детальные исследования нуклеотидной последовательности митохондриального генома показали, что отклонения от глобального генетического кода не являются редкостью в митохондриях животных и грибов. Так, в митохондриях человека кодон TAT кодирует аминокислоту метионин вместо изолейцина в стандартном коде, кодоны TST и TSS обычно кодируют аргинин, а кодон AST является станционным кодоном в стандарте код, кодирующий аминокислоту метионин. Что касается митохондрий растений, то они, по-видимому, используют универсальный генетический код. Еще одной особенностью митохондрий является их способность распознавать код тРНК. Это связано с тем, что такие молекулы могут распознавать не один, а три или четыре кодона одновременно. Эта особенность снижает важность третьего нуклеотида в кодоне и уменьшает количество типов тРНК, необходимых митохондриям. В этом случае достаточно только 22 типов тРНК.
Митохондрии имеют свой собственный генетический аппарат, а также собственную систему синтеза белка, характеризующуюся очень маленькими рибосомами животных и грибковых клеток. Он имеет фактор преципитации 55S, который даже ниже, чем у прокариотических рибосом 70s.. В то же время две большие рибосомальные РНК также меньше, чем у прокариот, а малая рРНК полностью отсутствует. Напротив, в митохондриях растений рибосомы по размеру и структуре сходны с прокариотами.
Митохондриальные белки
Ограниченное количество белков транслируется митохондриальными мРНК для формирования субъединиц более крупных ферментных комплексов. Значительная часть белков кодируется в ядре и синтезируется в цитоплазматической рибосоме 80S. В частности, таким образом образуются некоторые белки, такие как транспортеры электронов, митохондриальные транслоказы, компоненты транспорта белков в митохондрии, а также агенты, необходимые для транскрипции, трансляции и репликации митохондриальной ДНК. Эти белки имеют специфические сигнальные пептиды на N-концах, размер которых варьируется от 12 до 80 аминокислотных остатков. Эти участки образуют амфипатическую спираль и обеспечивают специфический контакт белка с участками связывания митохондриальных распознающих рецепторов на внешней мембране. До внешней мембраны митохондрий эти белки транспортируются в частично свернутом состоянии в сочетании с консервативными белками (особенно hsp70). После транспортировки через внешнюю и внутреннюю мембраны белки, попадающие в митохондрии, снова связываются с компаньоном митохондриального происхождения, который принимает белки, прошедшие через мембрану, облегчает их возвращение в митохондрии и контролирует процесс их переработки. Полипептидные цепи. Большинство гиперонов обладают АТФазной активностью, и, следовательно, как транспорт белков в митохондрии, так и образование их функционально активных форм являются энергозависимыми процессами.
Основная функция митохондрий — синтез АТФ, универсальной формы химической энергии во всех живых клетках. Как и у прокариот, эта молекула может производиться двумя способами. Либо в результате фосфорилирования субстрата в жидкой фазе (например, гликолиз), либо в процессе мембранного фосфорилирования, которое включает действие трансмембранных электрохимических ступеней (ионы водорода). Митохондрии используют оба этих пути, первый характерен для начального процесса окисления субстрата, который происходит внутриутробно, а второй завершает процесс генерации энергии и связывается с митохондриальной кристой. Специфика митохондрий как органелл, генерирующих энергию в эукариотических клетках, определяет второй способ генерации АТФ, называемый «хемосомной связью». По сути, это последовательное преобразование химической энергии восстановленных эквивалентов NADH в электрохимический градиент протонов ΔHH+ по обе стороны внутренней мембраны митохондрий, активирующий мембранную синтазу АТФ и завершающий образование макросвязанного АТФ. В моП.
В целом, весь процесс выработки энергии в митохондриях можно разделить на четыре основных этапа, первые два из которых происходят в матке, а последние два — в митохондриальных кристаллах.
- Превращение поступивших из цитоплазмы в митохондрию пирувата и жирных кислот в ацетил-СоА;
- Окисление ацетил-СоА в цикле Кребса, ведущее к образованию НАДН;
- Перенос электронов с НАДН на кислород по дыхательной цепи;
- Образование АТФ в результате деятельности мембранного АТФ-синтетазного комплекса.
Еще в цитоплазме, в серии из десяти отдельных ферментативных реакций, шестиуглеродная молекула глюкозы частично окисляется до двух трехуглеродных молекул пирувата с образованием двух молекул АТФ. Затем пируват транспортируется из лизата через внешнюю и внутреннюю мембраны в матрикс, где он сначала преобразуется в ацетил-КоА. Этот процесс катализируется большим пируватдегидрогеназным комплексом, сравнимым по размеру с рибосомой и состоящим из трех ферментов, пяти коферментов и двух регуляторных белков. Аналогичным образом, жирные кислоты, образующиеся в результате распада нерастворимых триглицеридов в цитозоле, транспортируются в митохондриальный матрикс в качестве производных ацетил-КоА.








