Род Blowfish составляет примерно одну восьмую часть генома человека и одну треть генома двустворчатых примитивных рыб. Какие «призраки» обитают на «кладбище геномов» и какие бесполезные элементы содержатся в нашей ДНК?
Геном человека: двадцать лет спустя
Двадцать лет назад президент США Билл Клинтон и премьер-министр Великобритании Тони Блэр объявили о том, что программа «Геном человека» и корпорация Celera Genomics завершили «первоначальное секвенирование генома человека». Считается, что с этого момента биология вступила в «постгеномную эру». Называя эту дату «днем секвенирования генома человека», можно в общих чертах сказать «днем, когда геном человека был секвенирован». На встрече ученые сообщили лишь о первоначальном проекте последовательности ДНК всех хромосом человека, но в нем было много пробелов, некоторые из которых сохранились до сих пор.. Обе публикации, описывающие «черновик» генома человека, появились в 2001 году, а «чистая» версия была опубликована три года спустя. С тех пор программа «Геном человека» была завершена, но расшифровка генома человека не была завершена. Обработка и заполнение полученных данных продолжается и по сей день. N + 1 рассказывает о судьбе, возможно, самого важного проекта для науки в 21 веке и о том, что он сделал и продолжает делать в мире.
Программу «Геном человека» иногда называют самым успешным международным научным сотрудничеством в истории. Однако поначалу научное сообщество не было настроено единодушно оптимистично — подготовка была встречена протестами общественности и язвительными статьями, в которых утверждалось, что прочитать последовательность человеческой ДНК невозможно и что деньги налогоплательщиков следует тратить на более полезные вещи. встречаются.
Чисто технические возможности секвенирования геномов демонстрируются с 1970-х годов, но когда был расшифрован первый вирусный геном, его не сразу сочли геномом человека. Согласно легенде, эта идея возникла благодаря биологу Роберту Синсхаймеру из Калифорнийского университета в Санта-Крузе. Его коллеги-астрономы работали над созданием крупнейшего (на тот момент) наземного телескопа, а Синсхаймер рассматривал проект аналогичного масштаба в области биологии.
В 1985 году он собрал ведущих генетиков, чтобы обсудить планы по секвенированию генома человека. Команда пришла к выводу, что идея привлекательна, но неосуществима. До этого времени геном E. coli также не был секвенирован, поскольку он состоял всего из пяти миллионов пар нуклеотидов, а максимальная длина последовательности нуклеотидов, которую можно было одновременно прочитать методом Сэнгера, составляла несколько сотен нуклеотидов.

Шкаф, содержащий часть генома человека, в коллекции Wellcome Collection, Лондон. Для полной записи потребовались бы сотни томов, каждый из которых содержал бы около 1 000 страниц.
Russ London/Wikimedia Commons.

Внутри тома с изображением генома человека в Wellcome Collection в Лондоне.
Адам Ниман / flickr / CC BY-SA 2.0
Уолтер Гилберт, который десять лет назад предложил метод секвенирования ДНК (известный как метод Максама-Гилберта или химическая деградация ДНК), присоединился к дебатам почти одновременно с Фредериком Сэнгером. Он увлекся идеей создания лаборатории генома, и его привлекли Джеймс Уотсон, первооткрыватель структуры ДНК, и Чарльз ДеРизи, глава Департамента здравоохранения и окружающей среды Министерства энергетики США. В случае с последними, геномная программа казалась логическим продолжением их исследований по воздействию радиации на человека. В 1986 году они уже подсчитали стоимость секвенирования генома человека.
Предпосылки и последствия
В 1980-х годах у генетиков уже были инструменты для изучения размеров хромосом и расположения генов. В основном с ферментативным разрешением рестрикции, разделением фрагментов в гелях и гибридизацией по радиоактивно меченным последовательностям. Подробное описание ДНК вместе с изобретением метода получения последовательности англичанином Фредериком Сэнгером ранее разработали метод считывания аминокислотной последовательности белковых молекул.
Далее, открытие ДНК-полимеразы сделало возможной последовательность ДНК Сэнгера — фермента, который гарантирует удвоение молекул ДНК в клетке путем комплементарной реорганизации нитей в одной биопродуцированной матке.
Этот метод основан на ферментативном достраивании второй нити в утробе нити, в отличие от чисто химического метода Максама-Гилберта (деградация ДНК по специфическим позициям модификации нуклеотидов). Это более продуктивно. Дополнительные нити синтезируются с использованием типичных нуклеотидов (a, t, g, c), но до определенного момента они добавляются в пробирку, радиолабильно помеченную доксинуклеотидом, после чего состав нити прекращается (тот же метод в настоящее время используется в рутинах секвенирования, но с флуоресцентными метками). используется вместо этого). Анализ гелей фрагментов разного размера, которые в итоге оказываются в одной и той же «букве», позволяет реконструировать всю нуклеотидную последовательность.
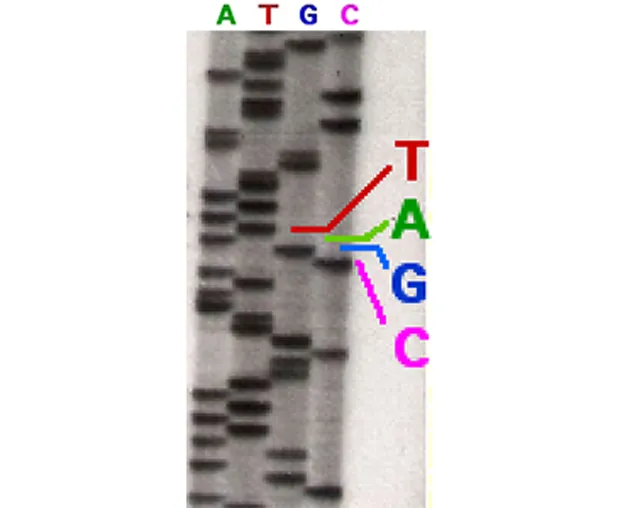
Часть расшифрованной последовательности в геле.
‘Чтобы получить представление о секвенировании генома, важно было не следовать последовательности, — объясняет Юрий Лебедев. — ‘Нам нужно было создать естественную карту хромосомы с рядом генов, структурных и регуляторных позиций. Это было сделано путем клонирования генетических носителей, тканей, бактерий и РНА, геномных треков, размером в десятки и сотни тысяч пар, и расположения известных генетических маркеров, с которыми можно сравнить эти фрагменты. До этого момента следует понимать, что многие гены человека уже были клонированы в кДНК (ДНК, соответствующая маточной РНК после расщепления некодирующих участков, примерно N+1). Для создания «колонок» и одновременного поиска новых индикаторов использовалось несколько последовательностей. Это заняло много времени. Вентер пошел на хитрость — он использовал уже существующую природную карту и просто приготовил последовательности.
Следует пояснить, что все данные, полученные на этом пути, были опубликованы в открытом доступе, включая карты хромосом с расположением генов. Этому в значительной степени способствовал Крейг Вентер, который использовал его для картирования последовательностей благодаря модифицированному «методу Shotgun».
«Для секвенирования каждый большой фрагмент был разделен на смесь более мелких перекрывающихся фрагментов, самый маленький фрагмент был переопределен как тело фага (M13), и вся смесь мелких фрагментов была захвачена с помощью автоматизированного секвенирования Sanger.»
На самом деле, метод сегментирования на более мелкие части известен как «метод дробовика». Первой большой последовательностью ДНК, прочитанной этим методом, был геном вируса мозаики цветной капусты в 1981 году. Вентер понял, что небольшие фрагменты генома можно считывать непосредственно с обеих сторон без необходимости клонировать их в векторы (требовалась известная последовательность). (сшиваются с концов). Благодаря этому усовершенствованию его команда смогла быстро прочитать последовательность из 70 миллионов фрагментов и связать их с готовой физической картой в течение трех лет. При стоимости всего 200 000 долларов США это намного дешевле, чем геном человека.
Первые итоги и дальнейшее развитие
Таким образом, к 2000 году они получили представление о последовательности считывания ДНК человека, или РНК-полимеразы, внутри эухроматина — области, где активно идет транскрипция.
По оценкам ученых, эухроматин составляет около 95 процентов всего генома. Остальная часть ДНК скрыта в плотных белковых комплексах и в основном «молчит». Помимо человека, как рекомендовали эксперты в 1990 году, были секвенированы геномы «599 вирусов и вирулентности, 205 природных плазмид, 185 органелл, 31 бактерии, семи приматов, грибов, двух животных и растений». Для официального финала проекта список был расширен за счет геномов мышей и крыс — животных моделей, без которых немыслимы важные медицинские исследования.
Конечно, необработанная последовательность символов — не единственный результат проекта. После расшифровки количества генов в геноме человека их число пришлось сократить со 100 000 до 30 000. Это в два раза больше, чем количество мух и червей. Об этом авторы пишут в знаменательной публикации в журнале Nature.
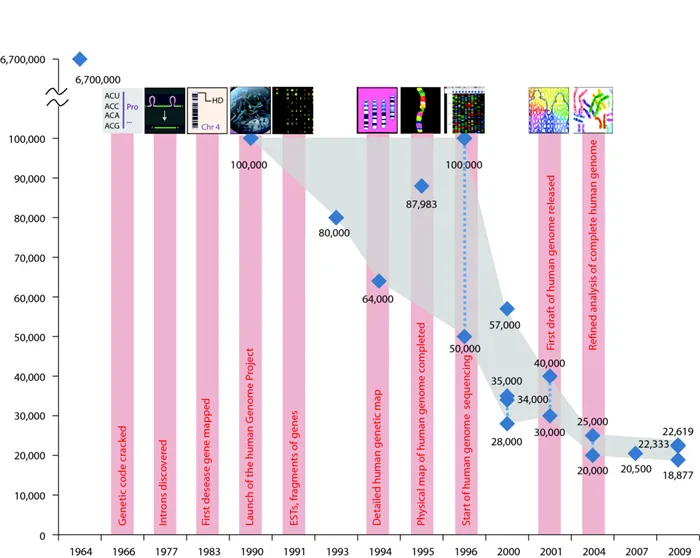
Как изменилось предполагаемое количество генов в геноме человека с 1964 по 2009 год.
Михаэла Пертеа и Стивен Зальцберг / Геномная биология, 2010.
Ученые также узнали, что геном человека содержит множество дубликатов и мобильных элементов, большинство из которых уже не функционируют. Кроме того, геном человека очень разнообразен — по оценкам генетиков, количество полиморфизмов нуклеотидов (часть генома, на которой у разных людей может стоять тот или иной нуклеотид) в нем может достигать 1,5 миллиона. Частично это объясняется тем, что в программе использовалась ДНК большого числа добровольцев, а не одного человека.
‘Есть много вещей, которых я не знал изначально. Я думал, что живу где-то на берегу моря, на маленьком острове. Затем, каким-то образом, когда я поднялся на гору, туман рассеялся, и я увидел, что это на самом деле был целый континент», — объясняет научные результаты проекта Михаил Гельфанд, в котором лаборатория участвовала в сборе и анализе генома человека.
Однако исследования генома только начались с публикации первых исследований генома. Гельфанд приводит пример. Мы следовали программе генома человека, например, программе кодирования, где люди уже изучали определенные функциональные вещи. Опять же, не только написать серию букв, но и понять, почему организация разная, почему гены разные, как устроен рак, как гены функционируют по-разному, как организована работа генов, сколько разных организаций происходит из одного типа клеток, как работает ген в период раннего развития Изменения. Упакованные в клетку, они подвергаются воздействию. Существует множество методик, которые не только рассказывают нам о функциональных вещах, но в основном связаны с последовательностью генома. Вы распознаете что-то, картируете геном и затем делаете из этого функциональные выводы. На самом деле, наука здесь — это наука. Это называется системной биологией, с которой мы начали. Здесь вы пытаетесь понять не только, как работают гены, но и как работают клетки, но с очень высоким уровнем детализации. А это практически невозможно без геномики. Опять же, уровень понимания принципа работы клетки кардинально изменился. Мы не похожи на слепого слона, который ищет разные аспекты, но теперь мы смотрим на всего слона.
В дополнение к генам, кодирующим белки, геном человека содержит тысячи генов РНК, включая РНК (тРНК), рННК, микроРНК (микроДНК) и другие последовательности РНК, которые не кодируют белки.
Полиморфизмы генов
Генетические полиморфизмы являются основными факторами, определяющими индивидуальные различия в развитии определенных физических и психических характеристик у людей. Масштабы генетических полиморфизмов человека таковы, что между последовательностями ДНК двух людей существуют миллионы различий. Эти различия условно делятся на четыре основные категории. (a) не фенотипические — b) вызывающие фенотипические различия — c) играющие роль в патогенезе заболевания (полигенные заболевания) — d-d) начало заболевания (моногенные заболевания). Сегодня созданы обширные базы данных, очень гибкие и быстро растущие. Они постоянно пополняются информацией, предоставляемой клиникам и исследовательским центрам по всему миру многими экспертами в области системной биологии и научными организациями, занимающимися молекулярной биологией и биоинформатикой. Изменения в конкретных генах при определенных условиях могут привести к развитию заболеваний. Сочетание предрасполагающих генов является генетическим риском для многих заболеваний. Тестирование на генетическую предрасположенность может помочь выявить индивидуальные риски возможных заболеваний и определить влияние и подверженность негативным факторам окружающей среды. Патология системы свертывания крови, метаболизм фолиевой кислоты, метаболизм костного белка, гормоны щитовидной железы, стероидные гормоны и многочисленные другие группы полиморфизмов выделяют клинические группы полиморфизмов. В настоящее время в КЛ обнаружены генетические полиморфизмы генов свертывания крови: ген F2 (20210_G> A), ген F5 (1691_G> A), ген F7 (10976_G> A), ген F13 (103_G> T), ген FGB (455_G> A ), ITGA 2/Intragloss A-2/ (807_C> T), ITGB 3/B-3/ (1565_T> C) и ген PAI-1 (675_5G> 4G). Результаты этого исследования дают интерпретацию и объяснение опасностей, связанных с любой из комбинаций. В ближайшем будущем произойдет значительное расширение спектра выявляемых полиморфизмов в CL.
Результаты ПЦР обнаруживаются в режиме реального времени. Управление прибором осуществляется с помощью программного обеспечения. Программное обеспечение обеспечивает простое и интуитивно понятное управление с помощью функции «тест», что значительно сокращает время, необходимое для создания протоколов испытаний. Программное обеспечение включает приложения для количественного определения ДНК/кДНК, анализа кривых, снижения уровня экспрессии генов, биологических исследований и анализа SNP. Она позволяет использовать «дополнительные стандартные» функции и создавать протоколы исследований с автоматизированной интерпретацией полученных результатов. Научно-технический прогресс привел к необходимому открытию в области молекулярной биологии — открытию метода полимеразной цепной реакции (ПЦР), с помощью которого можно обнаружить даже небольшие участки искомого генома. Полимеразная цепная реакция первоначально использовалась только в научных лабораториях. Однако вскоре он нашел свой путь в медицине. В 1993 году Кэри Маллис, ученый, открывший метод ПЦР, был удостоен Нобелевской премии по химии.
Диагностика полиморфизмов генов в медицинской лаборатории CL
Сегодня современные технологии молекулярно-генетической диагностики позволяют выявлять полиморфизмы. Лабораторные исследования CL С 2012 года для проведения полимеразной цепной реакции (ПЦР) используется амплификатор DTPRime компании «Русская ДНК-Технология». Принцип ПЦР основан на методе многократного комплементарного восполнения матки нуклеиновых кислот в дуплексной структуре, что позволяет органам «видеть» и распознавать полиморфизмы. Помимо быстроты и простоты, метод ПЦР является очень чувствительным и специальным. Принцип метода с большой ясностью объясняется среди работников лаборатории следующим образом: «найти иголки в стоге сена, а затем сделать стог из этих иголок». Чтобы исключить неточности, один и тот же участок гена исследуется многократно. Вся нить ДНК анализируется на участках, где предсказаны полиморфизмы, и в последующих регионах. Эти баллы снимаются и присваиваются. При использовании ПЦР количество этих позиций увеличивается с 10 до 36-40о. Каждый сайт читается десятки раз. Только после этого можно построить статистическую кривую.
Информация о наличии полиморфизмов, знание их влияния на определенные виды метаболизма и уровень чувствительности препаратов позволяют оценить риск развития заболевания, предотвратить его рост и назначить соответствующее лечение. Важным фактом является то, что генетические полиморфизмы не меняются в течение жизни, они определяются один раз! Результаты не меняются в течение всей жизни и не зависят от нормального состояния организма. Генетическое тестирование позволяет в период скрининга выявить наследственные тенденции к заболеваниям, которые проявляются только на ранних стадиях развития геномики и скульптуры. Интерпретация результатов анализа полиморфизма важна для врачей. Им необходимо понять, как тот или иной полиморфизм связан с вероятностью возникновения патологического состояния. Следует отметить, что полиморфизм — это не нозология, а лишь один из ее элементов, но зачастую важный. Наличие полиморфизма может быть учтено при назначении препарата. Например, врачи, руководствуясь рекомендациями генетиков, могут изменять концентрацию или дозировку препаратов, влияющих на компонент свертывания крови. Конечно, режим, диета и физиотерапия также важны, но главная роль отводится лекарственной терапии. И это область фармакогенеза, которая изучает реакцию организма на конкретные лекарства в соответствии с особенностями человеческого генома.
Интеграция наук
Пятнадцать лет назад было объявлено, что геном человека расшифрован. Это открытие стало возможным благодаря многолетней работе ученых из разных научных дисциплин. Это уровень, на котором информация и знания из одного сектора проникают в другой. Это «завершение науки» выводит дальнейшее развитие биотехнологий, медицины, генетики и геномики на качественно новый уровень. Трудно предсказать, каких горизонтов достигнут ученые, обладающие подробными знаниями о геноме человека. Только природа может поставить перед человеком новые, менее сложные задачи и амбициозные цели.
Данный материал был опубликован в журнале «Протест» № 2, выпуск 2, 2 августа 2015 года. При использовании материала ссылка на журнал обязательна.








